
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Устойчивость комплексных соединений
|
|
Комплексные соединения ведут себя как сильные электролиты, т.е. при растворении практически полностью диссоциируют на комплексные ионы (внутренняя сфера) и противоионы (внешняя сфера).
Например: K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3─
Однако комплексные ионы являются слабыми электролитами и диссоциируют лишь в незначительной степени.
Например: [Fe(CN)6]3─ ↔ Fe3+ + 6CN─
Применяя закон действующих масс к процессу диссоциации комплексного иона, можно записать:
Kд = Kн = 
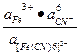 - константа диссоциации комплекса или константа нестойкости.
- константа диссоциации комплекса или константа нестойкости.
Константа нестойкости характеризует способность комплексного иона распадаться на образующие его частицы. Чем ниже значение константы нестойкости, тем прочнее, устойчивее комплекс.
Процесс распада комплексных ионов в растворе протекает многоступенчато, с последовательным отщеплением лигандов:
[Cu(NH3)4]2+↔ [Cu(NH3)3]2++NH3 Kд, 1=7, 2 · 10-3
[Cu(NH3)3]2+↔ [Cu(NH3)2]2+ + NH3 Kд, 2=1, 3 · 10-3
[Cu(NH3)2]2+↔ [Cu(NH3)]2+ + NH3 Kд, 3=3, 2 · 10-4
[Cu(NH3)]2+ ↔ Cu2+ + NH3 Kд, 4=7, 1 · 10-5
 [Cu(NH3)4]2+ ↔ Cu2+ + 4 NH3 Кн
[Cu(NH3)4]2+ ↔ Cu2+ + 4 NH3 Кн
Кн = Kд, 1 · Kд, 2 · Kд, 3 · Kд, 4 = 2, 1 · 10-13
Задачи
1. Назовите соединения:
а) [Co(H2O)6]Cl2
б) K2[CoCl4]
2.Назовите соединения:
а) [Co(NH3)5Cl]Cl2
б) Na[Al(CH)4]
3. Назовите соединения:
а) [Co(NH3)5Br]SO4
б) K[Al(SO4)2]
4. Напишите формулы следующих соединений:
а) гексохлороплатинат (IV) калия
б) хлорид гексаамминоплатины (IV)
5. Напишите формулы следующих соединений:
а) дигидроксотетрахлороплатинат (IV) аммония
б) хлорид хлоропентааквахрома (III).
6. Напишите формулы следующих соединений:
а) хлорид тетраамминоцинка
б) бромид дихлоротетрааммин платины (IV).
7. Определить заряды комплексных ионов, образованных Pt+4:
а) [Pt(NH3)2Cl2]
б) [Pt(OH)2Cl4]
8. Определите заряд комплексообразователя в ионах:
а) [Cr(H2O)3F3]0
б) [Ag(NH3)2]+
9. Определите заряды комплексных ионов, образованных ионами Sn2+ и Sn+4:
а) [Sn(OH)4]
б) [Sn(OH)6]
10. Напишите диссоциацию комплексных соединений и комплексных ионов. Для комплексного иона запишите выражение константы нестойкости:
а) K2[PtBr4]
б) Ba[Cr(CNS)4(NH3)2]2
11. Напишите диссоциацию комплексных соединений и комплексных ионов. Для комплексного иона запишите выражение константы нестойкости:
а) [Co(NH3)5Br]SO4
б) [Cr(H2O)6]Br3
12. Напишите диссоциацию комплексных соединений и комплексных ионов. Для комплексного иона запишите выражение константы нестойкости:
а) [Al(H2O)6]Cl3
б) H2[SiF6]
13. Для комплексного соединения K2[Co(NH3)(NO2)5] укажите:
а) внутреннюю сферу;
б) внешнюю сферу;
в) комплексообразователь, заряд комплексообразователя;
г) лиганды;
д) заряд комплексного иона;
е) назовите соединение.
14. Для комплексного соединения Ba[Cr(SCN)4(HN3)2]2 укажите:
а) внутреннюю сферу;
б) внешнюю сферу;
в) комплексообразователь, заряд комплексообразователя;
г) лиганды;
д) заряд комплексного иона.
е) назовите соединение.
15. Для комплексного соединения K[Pt(NH3)Cl3] укажите:
а) внутреннюю сферу;
б) внешнюю сферу;
в) комплексообразователь, заряд комплексообразователя;
г) лиганды;
д) заряд комплексного иона.
е) назовите соединение.
32. КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Неорганические соединения классифицируются по составу или по свойствам (функциональным признакам). По составу они делятся на простые – это одноэлементные соединения и сложные – двухэлементные (бинарные) и многоэлементные.
Сложные неорганические соединения согласно таблице, кроме подразделений по составу, в свою очередь подразделяются по функциональному признаку на оксиды, гидроксиды (кислоты и основания) и соли.
Таблица2
Классификация неорганических соединений
| Простые | Сложные |
| Металлы (85 элементов): s-элементы (кроме Н, Не) p-элементы Al, Ga, In, Tl, Ge, Sn, Pb, Sb, Bi; d-элементы; f-элементы. Неметаллы (22 элемента): s-элементы Н, Не; р-элементы B, C, Si, N, P, As, O, S, Se, Te, галогены, благородные газы | Двухэлементные (бинарные): Гидриды LiH, NaH, CaH2, Карбиды SiC, CaC2, Al4C3, Нитриды Na3N, Mg3N2, Оксиды CaO, Al2O3, Сульфиды K2S, ZnS, Галиды NaCl, FeCl3, Многоэлементные: Соли: Средние NaNO3, K3PO4, Кислые NaHSO4, KH2PO, (гидро-) Ca(HCO3)2 основные MgOHCl, Al(OH)2Cl, (гидроксо-) (CuOH2)SO4; Гидроксиды: Кислоты HNO3, H2SO4, H3PO4, Основания KOH, Ni(OH)2, Ba(OH)2 Амфолиты Zn(OH)2, Al(OH)3, (амфотерные) H2ZnO2, H3AlO3 |
32.1. Оксиды. Номенклатура, классификация оксидов
Оксидами называются сложные вещества, молекулы которых состоят из двух различных видов атомов, один из которых – кислород.
В отечественной химической литературе при обозначении оксидов придерживаются следующего порядка:
1) при написании формул кислород всегда ставят на второе место – NO, CaO;
2) в названиях оксидов вначале пишут слово «оксид», а затем название второго элемента в родительном падеже: ВаО – оксид бария; К2О – оксид калия;
3) если элемент может образовывать несколько оксидов, то после названия элемента в скобках указывают степень окисления: N2O5 – оксид азота (V); N2O – оксид азота (I); FeO - оксид железа (II); Fe2O3 – оксид железа (III);
4) в названиях более распространенных оксидов соотношения атомов в молекуле можно обозначать с помощью соответствующих греческих числительных: N2O – гелиоксид диазота;; NO – монооксид азота; NO2 – диоксид азота; N2O5 - гепипентаоксид азота.
32.2. Получение оксидов и их свойства. Основные, кислотные и амфотерные оксиды
Оксиды могут быть получены следующими способами.
1. Взаимодействием простых веществ с кислородом. В большинстве случаев простые вещества при нагревании в присутствии кислорода окисляются с выделением света и теплоты. Этот процесс окисления называется горением:
C + O2 = CO2
2 Mg + O2 = 2 MgO
2. Взаимодействием сложных веществ с кислородом (горение). При таком взаимодействии образуются оксиды атомов, входящих в состав данного сложного вещества:
2 H2S + 3O2 = 2 H2O + 2 SO2
3. Разложением нитратов (а), карбонатов(б), сульфатов (в) и гидроксидов (г):
а) 2Cu(NO3)2 = 2CuO + 4 NO2 + O2
б) CaCO3 = CaO + CO2
в) Fe(SO4)3 = Fe2O3 + 3 SO3
г) Cu(OH)2 = CuO + H2O
4. Окислением металлов оксидами других элементов. На подобных реакциях основана металлотермия – процесс восстановления металлов из их оксидов более активными металлами:
2 Al + Cr2O3 = 2 Cr + Al2O3
5. Взаимодействием металлов или неметаллов с кислородсодержащими кислотами:
Cu + 4 HNO3 = Cu(NO3)2 + 2 NO2 + 2 H2O
C + HNO3 = 3 CO2 + 4 NO + 2 H2O
6. Разложением высших оксидов или, наоборот, доокислением низших оксидов:
4 CrO3 = 2 Cr2O3 + 3 O2
4 FeO + O2 = 2 Fe2O3
2 CO + O2 = 2 CO2
Различают солеобразующие и несолеобразующие (безразличные) оксиды. К последним относятся такие, которые не образуют ни кислот, ни оснований (например, N2O, NO, SiO), поэтому их называют еще безразличными.
Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные.
Основными оксидами называются оксиды, образующие соли при взаимодействии с кислотами и кислотными оксидами. Основным оксидам отвечают основания. Так, Na2O, CaO, MgO являются основными оксидами, так как им соответствуют основания NaOH, Ca(OH)2, Mg(OH)2. Оксиды К2О и СаО хорошо растворяются в воде с образованием соответствующих оснований:
СаО + Н2О = Са(ОН)2
К2О + Н2О = 2 КОН
Оксиды Fe2O3, CuO, Ag2O нерастворимы в воде и не участвуют в реакциях образования оснований. Однако они взаимодействуют с кислотами с образованием солей, поэтому считаются основными:
Fe2O3 + 6 HCl = 2 FeCl3 + 3 H2O
CuO + H2SO4 = CuSO4 + H2O
Ag2O + 2 HNO3 = 2 AgNO3 + H2O
Основные оксиды могут взаимодействовать и с кислотными оксидами:
CaO + CO2 = CaCO3
3 BaO + P2O5 = Ba3(PO4)2
Кислотными называются оксиды, образующие соли при взаимодействии с основаниями и основными оксидами. Присоединяя прямо или косвенно воду, кислотные оксиды образуют кислоты, например, диоксид кремния SiO2 – кремниевую кислоту H2SiO3, оксид азота (III) N2O3 – азотистую кислоту HNO2, оксид азота (V) N2O5 - азотную кислоту HNO3, оксид серы (VI) SO3 – серную кислоту H2SO4. Кислотные оксиды образуются неметаллами.
Кислотные оксиды могут быть получены путем отнятия воды от соответствующих кислот, поэтому их называют также ангидридами кислот.
Характерным химическим свойством кислотных оксидов является их взаимодействие с основаниями (щелочами) с образованием соли и воды:
2 NaOH + CO2 = Na2CO3 + H2O
сплавление
SiO2 + 2 NaOH = Na2SiO3 + H2O
Большинство кислотных оксидов взаимодействуют с водой, образуя соответствующие кислоты:
P2O5 + 3 H2O = 2 H3PO4
Также кислотные оксиды взаимодействуют с основными оксидами, образуя соли соответствующих кислот:
CO2 + BaO = BaCO3
Амфотерными называются оксиды, которые образуют соли при взаимодействии как с кислотами, так и с основаниями. К амфотерным оксидам относятся, например, ZnO, Al2O3, SnO, SnO2, PbO, Cr2O3.
Амфотерные оксиды ведут себя как основные оксиды при взаимодействии с кислотами и как кислотные оксиды при взаимодействии с основаниями, т.е. обладают двойственной природой:
ZnO + 2 HCl = ZnCl2 + H2O
ZnO + 2 NaOH = Na2ZnO2 + H2O
цинкат натрия
(соль цинковой кислоты H2ZnO2)
Все амфотерные оксиды являются оксидами металлов.
Кислотные, основные, амфотерные оксиды относятся к солеобразующим оксидам, так как все они образуют соли.
Несолеобразующие оксиды не взаимодействуют ни с кислотами, ни с основаниями. К ним относятся оксид азота (I) N2O, оксид азота (II) NO, оксид углерода (II) CO и др.
Контрольные вопросы
1) Какие соединения называются оксидами?
2) На какие два типа делятся все оксиды?
3) Что такое солеобразующие оксиды? Приведите примеры.
4) На какие типы делятся солеобразующие оксиды?
5) Какие оксиды называются основными? Приведите примеры.
6) Какие оксиды называются кислотными? Приведите примеры.
7) Какие оксиды называются амфотерными? Приведите примеры.
8) Какие оксиды образуют неметаллы?
9) Какие элементы-металлы или неметаллы – образуют основные и амфотерные оксиды?
10) Что такое несолеобразующие оксиды? Приведите примеры.
Упражнения для самостоятельной работы
1) Классифицируйте следующие солеобразующие оксиды: SO2, K2O, N2O5, Al2O3, FeO, BaO, MnO2, Mn2O7, P2O3, Ag2O.
2) Назовите следующие оксиды: а) N2O3; б) ZnO; в) CuO; г) PbO2; д) Mn2O3; е) MgO; ж) P2O5; з) Cl2O7; и) SiO2; к) SO3; л) K2O; м) Fe2O3 .
3) Напишите формулы оксидов, которым соответствуют следующие основания: Mg(OH)2, LiOH, Fe(OH)3, Bi((OH)3, Cu(OH)2.
4) Напишите формулы оснований, которые соответствуют следующими оксидам: NiO, K2O, Co2O3, CuO, Cs2O.
5) Какие из приведенных оксидов относятся к основным: SO2, Cu2O, FeO, SiO2, SO3, SrO?
6) Напишите формулы ангидридов указанных кислот: H2SO4, H3BO3, HClO, HClO2, HMnO4, H2MnO4, H3AsO4, H2WO4.
7) Как доказать амфотерный характер ZnO, Al2O3, Cr(OH)2, Cr(OH)3.
8) Напишите молекулярные формулы следующих оксидов: а) оксид ртути (II); б) оксид хлора (V); в) оксид марганца (VI); г) оксид серы (IV); д) оксид калия; е) оксид железа (II); ж) оксид серебра (I); з) оксид свинца (IV); и) оксид олова (II); к) оксид никеля (II); л) оксид иода (VII).
9) С помощью соответствующих уравнений реакций покажите отличия основных и кислотных оксидов.
32.3. ГИДРОКСИДЫ (ОСНОВАНИЯ). НОМЕНКЛАТУРА, КЛАССИФИКАЦИЯ ГИДРОКСИДОВ
Гидроксидами называются сложные вещества, в молекулах которых атом металла связан с одной или несколькими гидроксигруппами. Согласно теории электролитической диссоциации основания – это электролиты, которые при диссоциации высвобождают гидроксид-анионы:
NaOH ↔ Na+ + OH-.
Ca(OH)2 ↔ Ca2+ + 2 OH-
При написании названий оснований придерживаются следующих правил: сначала пишут слово «гидроксид», а затем название металла в родительном падеже: гидроксид натрия NaOH, гидроксид кальция Ca(OH)2.
Если один и тот же элемент с различной степенью окисления образует основания, то в каждом случае после его названия в круглых скобках римской цифрой показывают степень окисления этого элемента: Fe(OH)2 – гидроксид железа (II); Fe(OH)3 - гидроксид железа (III).
Гидроксиды, образованные щелочными и щелочноземельными металлами, называются щелочами: KOH, NaOH, Ca(OH)2.
Гидроксигруппы определяют кислотность основания, т.е. способность данного основания нейтрализовать кислоты. Например, NaOH, KOH, LiOH и др. – однокислотные основания; Ca(OH)2, Fe(OH)2 и др. – двухкислотные основания; Ni(OH)3, Bi(OH)3 и др. – трехкислотные основания.
Двух- и трехкислотные основания называются многокислотными.
32.4. Свойства оснований
Характерным свойством оснований является их способность взаимодействовать с кислотами, кислотными и амфотерными оксидами (реакции нейтрализации), солями (реакции обмена).
NaOH + HCl = NaCl + H2O
Ca(OH)2 + CO2 = CaCO3 + H2O
2 KOH + ZnO = K2ZnO2 + H2O
Ba(OH)2 + Na2SO4 = BaSO4↓ + 2 NaOH
Из других химических свойств оснований следует отметить их отношение к нагреванию. Многие основания при нагревании разлагаются с образованием соответствующего оксида и воды:
Cu(OH)2 = CuO + H2O
Некоторые основания разлагаются лишь при нагревании:
Ca(OH)2 = CaO + H2O.
Устойчивы к нагреванию гидроксиды щелочных металлов.
Характерная особенность оснований – их способность изменять окраску индикаторов. Так, бесцветный раствор фенолфталеина в присутствии следов щелочи приобретает малиновую окраску, меловый оранжевый – желтую, а красный лакмус – синюю окраску.
32.5. Понятие об амфотерных гидроксидах
По аналогии с амфотерными оксидами существуют амфотерные гидроксиды: это такие гидроксиды, которые в зависимости от условий могут проявлять как основные, так и кислотные свойства.
При взаимодействии с кислотами амфотерные гидроксиды проявляют свойства оснований, а при взаимодействии с основаниями – свойства кислот:
Zn(OH)2 + 2 HCl = ZnCl2 + 2 H2O
Zn(OH)2 + 2 NaOH = Na2ZnO2 + 2 H2O
К амфотерным гидроксидам относятся, например, Zn(OH)2, Al(OH)3, Pb(OH)2, Sn(OH)2, Cr(OH)3.
Контрольные вопросы
1) Какие соединения называются гидроксидами? Приведите примеры.
2) Что называется щелочами? Приведите примеры.
3) Что определяет кислотность основания?
4) На какие группы делятся основания по кислотности? Приведите примеры.
5) На какие группы делятся основания по растворимости в воде? Приведите примеры.
6) Какие гидроксиды называются амфотерными? Приведите примеры.
Упражнения для самостоятельной работы
1) Классифицируйте следующие основания по кислотности: PBOH, Fe(OH)2, Mn(OH)2, Co(OH)3, Fe(OH)3, FeOH.
2) Какие из данных оснований являются щелочами: Fe(OH)2, KOH, Co(OH)3, Ni(OH)2, CsOH?
3) Напишите названия следующих оснований: а) Mg(OH)2; б) KOH; в) Ni(OH)2; г) Cu(OH)2; д) Hg(OH)2; е) Ca(OH)2; ж) Pt(OH)2 з) Mn(OH)3; и) Fe(OH)2; к) Fe(OH)3.
4) Среди следующих соединений найдите основания и назовите их: HNO2; NaOH, HCl, Hg(OH)2, P2O5, NaHCO3, Mn2O7, CH3COOH, Cd(OH)2, Co(OH)3, Al(OH)2Cl, Ra(OH)2.
5) Какие из приведенных веществ будут реагировать с гидроксидом натрия: H2SO4, Mg(OH)2, N2O5, CuSO4, CaO. Составьте уравнения соответствующих реакций.
6) Что образуется при нагревании Ni(OH)2, Fe(OH)3?
7) Какие из приведенных гидроксидов обладают амфотерными свойствами: Ca(OH)2, Al(OH)3, LiOH, Pb(OH)2, Mg(OH)2? Написать уравнения реакций, доказывающие амфотерный характер данных гидроксидов.
8) Какие гидроксиды соответствуют оксидам Na2O, MnO, CuO, CaO, Al2O3? Объясните отношение этих гидроксидов к нагреванию.
9) Какие из указанных веществ реагируют с гидроксидом натрия: HNO3, CaO, CO2, CuSO4, Cd(OH)2, P2O5? Составьте уравнения реакций.
10) Какие из указанных газов вступают в химическое взаимодействие с раствором щелочи: HCl, H2S, NO2, N2, Cl2, CH4, SO2, NH3. Написать уравнения соответствующих реакций.
КИСЛОТЫ. КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА КИСЛОТ
Кислотами называются сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться атомами металла.
Число таких атомов водорода определяет основность кислот. В соответствии с этим различают одноосновные кислоты, молекулы которых содержат один атом водорода: HСl, HNO3, HCN и др.; двухосновные, молекулы которых содержат два атома водорода: H2S, H2SO4, H2CO3 и др.; трехосновные, молекулы которых содержат три атома водорода: H3PO4, H3BO3, H3AsO4 и др; четырехосновные: H4P2O7 и др.
Кислоты, молекулы которых содержат два и более атомов водорода, называются многоосновными.
По содержанию атомов кислорода в молекуле кислоты делятся на: кислородсодержащие, молекулы которых содержат атомы кислорода (HNO3, H2SO4, H3PO4 и др.); бескислородные, молекулы которых не содержат атомов кислорода (HCl, HBr, HCN, H2S и др.).
Названия кислот производят от элемента, образующего кислоту.
В бескислородных кислотах к названию элемента (или группы элементов, например, CN – циан), образующего кислоту добавляют суффикс “о” и слово “водород”: HF – фтороводород, H2S – сероводород, HCN – циановодород.
В состав кислородсодержащих кислот входят многоатомные анионы (электроотрицательные составляющие). При этом названия анионов приобретают суффикс –ат или –ит: SO42- - сульфат; ClО3- - хлорат; SO32- - сульфит и др. По мере понижения степени окисления суффиксы изменяются в следующей последовательности: “….оват (ая)”; “…ист(ая)”; “….оватист(ая)”; например, HClO3 – хлорновая, HClO2 – хлористая, HOCl - хлорноватистая кислоты. Если элемент образует кислоты только в двух степенях окисления, то для названия кислоты, соответствующей низшей степени окисления элемента, используется суффикс “….ист(ая)”, например, HNO2 - азотистая кислота.
Приставки орто- и мета- применяются для обозначения кислот с одним и тем же характеристическим элементом (например, НРО3, Н3РО4), но отличающихся числом атомов кислорода, то название кислоты, содержащей наименьшее число атомов кислорода снабжается приставкой “мета”, а название кислоты с наибольшим числом атомов кислорода – приставкой “орто” (НРО3 – метафосфорная кислота, Н3РО4 – ортофосфорная кислота).
32.7. Свойства кислот
Характерным свойством кислот является их способность взаимодействовать с основаниями, основными и амфотерными оксидами, солями с образованием солей, например:
2 HNO3 + Cu(OH)2 = Cu(NO3)2 + 2 H2O
2 HCl + CaO = CaCl2 + H2O
H2SO4 + ZnO = ZnSO4 + H2O
H2SO4 + Pb(NO3)2 = PbSO4↓ + 2 HNO3
Большинство кислот в водных растворах взаимодействуют с металлами. Обязательными продуктами реакции являются соль и водород (исключение азотная кислота).
Zn + 2 HCl = ZnCl2 + H2↓
Fe + H2SO4(разб.) = FeSO4 + H2↑
Однако не все металлы одинаково ведут себя с разбавленными кислотами. Каждый металл обладает различной химической активностью по способности вытеснять водород. Их можно расположить в ряд, называемый электрохимическим рядом напряжений металлов:
K, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Au.
Каждый из металлов, стоящий в этом ряду левее водорода, может вытеснять водород из растворов кислот, а стоящие правее – не могут.
Следовательно, такие металлы, как ртуть, медь, серебро и золото, не вытесняют водорода из кислот.
Zn + 2 HCl = ZnCl2 + H2
Cu + H2SO4 (разб) ≠ реакция не протекает
Формулы и названия наиболее важных кислот приведены в таблице3:
Таблица3
Формулы и названия важнейших кислот и их солей
| Кислота | Названия | |
| Кислоты | соли | |
| HAlO2 HAsO3 H3AsO4 HasO2 H3AsO3 HBO2 H3BO3 H2B4O7 HBr HOBr HbrO3 HCOOH CH3COOH HCN H2CO3 H2C2O4 HCl HOCl HClO2 HClO3 HClO4 HCrO2 H2CrO4 H2Cr2O7 HJ HOJ HJO3 HJO4 HMnO4 H2MnO4 H2MoO4 HN3 HNO2 HNO3 HPO3 H3PO4 H4P2O7 H3PO3 H3PO2 H2S HSCN H2SO3 H2SO4 H2S2O3 H2S2O7 H2S2O8 H2Se H2SeO3 H2SeO4 H2SiO3 HVO3 H2WO4 | Метаалюминиевая Метамышьяковая Ортомышьяковая Метамышьяковистая Ортомышьяковистая Метаборная Ортоборная Четырехборная Бромоводород Бромноватистая Бромноватая Муравьиная Уксусная Циановодород Угольная Щавелевая Хлороводород Хлорноватистая Хлористая Хлорноватая Хлорная Метахромистая Хромовая Двухромовая Иодоводород Иодноватистая Иодноватая Иодная Марганцовая Марганцовистая Молибденовая Азидоводород (азотистоводородная) Азотистая Азотная Метафосфорная Ортофосфорная Двуфосфорная (пирофосфорная) Фосфористая Фосфорноватистая Сероводород Родановодород Сернистая Серная Тиосерная Двусерная (пиросерная) Пероксодвусерная (надсерная) Селеноводород Селенистая Селеновая Кремниевая Ванадиевая Вольфрамовая | Метаалюминат Метаарсенат Ортоарсенат Метаарсенит Ортоарсенит Метаборат Ортоборат Тетраборат Бромид Гипобромит Бромат Формиат ацетат Цианид Карбонат Оксалат Хлорид Гипохлорит Хлорит Хлорат Перхлорат Метахромит Хромат Дихромат Иодид Гипоиодит Иодат Периодат Перманганат Манганат Молибдат Азид Нитрит Нитрат Метафосфат Ортофосфат Дифосфат (пирофосфат) Фосфит Гипофосфит Сульфид Роданид Сульфит Сульфат Тиосульфат Дисульфат (пиросульфат) Пероксодисульфат (персульфат) Селенид Селенит Селенат Силикат Ваданат вольфрамат |
Контрольные вопросы
1) Что такое кислоты?
2) Чем определяется валентность кислотного остатка?
3) Что такое основность кислоты?
4) Что такое одноосновные, многоосновные кислоты? Приведите примеры.
5) Что такое бескислородные кислоты? Приведите примеры.
6) Что такое кислородсодержащие кислоты (оксокислоты)? Приведите примеры.
7) Гидратами каких оксидов являются оксокислоты?
8) Что называется кислообразующим элементом?
9) Приведите примеры формул и названий бескислородных кислот и их кислотных остатков.
10) Приведите примеры формул и названий оксокислот и их кислотных остатков.
Упражнения для самостоятельной работы
1) Определите валентность кислотных остатков в следующих кислотах: H3BO3, HсlO4, H2SiO3, HCN, H3SbO4, H2Cr2O7.
2) Классифицируйте следующие кислоты по основности и по содержанию атомов кислорода: HJ, H3AsO4, H2S, HNO2, HmnO4, H2CO3.
3) Напишите формулы и названия кислот, которые соответствуют следующим кислотным оксидам: SO2, SO3, P2O5, N2O5, Mn2O7, CrO3, SiO2, P2O3, Cl2O.
4) Напишите формулы и названия оксидов, гидратами которых являются следующие кислоты: H2SiO3, HNO2, H2CrO4, HclO3, H3PO4, H2Cr2O7, H2MnO4, HclO2.
5) Каким из следующих оксидов соответствуют кислоты: MgO, Mn2O7, CO, P2O3, N2O, Cl2O7, SiO, FeO, Na2O, NO, SO2, CrO3? Напишите формулы и названия этих кислот.
6) Каким кислотам соответствуют кислотные остатки сульфат и сульфит? Напишите кислые соли и средние соли, содержащие в своем составе эти анионы.
7) Какие кислоты могут быть получены непосредственным взаимодействием с водой оксидов: P2O5, CO2, N2O5, NO2, SO2?
8) С каким из перечисленных ниже веществ будет реагировать соляная кислота: N2O5, Zn(OH)2, CaO, AgNO3, H3PO4, H2SO4? Составить уравнения реакций.
9) Какая формула соответствует марганцовистой кислоте: а) HMnO4; б) H4MnO4; в) H2MnO4?
10) Какие продукты можно получить при действии серной кислоты: а) на хлорид натрия; б) на сульфат натрия?
32.8.СОЛИ. КЛАССИФИКАЦИЯ СОЛЕЙ
Солью называют сложное вещество – продукт полного или частичного замещения атомов водорода в молекуле кислоты на металл или продукт полного или частичного замещения гидроксигруппы в молекуле основания на кислотный остаток.
Всякая соль состоит из основного и кислотного остатков. Средние соли диссоциируют на катионы металлов и анионы кислотных остатков.
KCl «K+ + Cl-
(NH4)2SO4 «2NH4+ + SO42-
Na3PO4 «3 Na+ + PO43-
Например, из серной кислоты H2SO4 можно получить два типа солей: Na2SO4 - продукт полного замещения водорода на атомы натрия и NaHSO4 – продукт частичного замещения атомов водорода. В зависимости от полноты замещения различают средние, кислые и основные соли.
Средние или нормальные соли: например, MgSO4, K2SO4, Ca3(PO4)2 – продукты полного замещения атомов водорода в молекуле кислоты на атомы металлы:
H2SO4 + 2 KOH = K2SO4 + 2 H2O
Кислые соли: например, KHSO4, Ca(H2PO4)2, CaHPO4 – продукт неполного, частичного замещения атомов водорода в молекуле кислоты на атом металла.
H2SO4 + KOH = KHSO4 + H2O
Кислые соли образуются многоосновными кислотами. При диссоциации кислых солей вначале образуются ионы металлов, а затем ионы водорода. Например:
KHSO4 «K+ + HSO4-
HSO4 «H+ + SO42-
Основные соли: например, Al(OH)SO4, MgOHCl – продукт частичного замещения гидроксигрупп в молекуле основания на кислотный остаток.
Fe(OH)3 + H2SO4 = FeOHSO4 + 2 H2O
Основные соли образуются только многокислотными основаниями. У основных солей вначале образуются кислотные остатки, а затем гидроксид-ионы. Например:
Mg(OH)Cl «Mg(OH)+ + Cl-
Mg(OH)+ «Mg2+ + OH-
|
|
