
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Второй группы
|
|
| Строение внешнего и предвнешнего электрон- ных слоев атома Радиус атома, нм Энергия ионизации Э ® Э+, эВ Э+ ® Э2+, эВ Радиус иона Э2+, нм Стандартная энтальпия атомизации металла при 250С, кДж на 1 моль атомов Плотность, г/см3 Температура плавления, оС Температура кипения, оС Стандартный электродный потенциал процесса Э2+ + 2е- = Э, В | Zn | Cd | Hg |
| 3s23p63d104s2 0, 139 9, 39 17, 96 0, 083 130, 5 7, 13 419, 5 -0, 763 | 4s24p64d105s2 0, 156 8, 99 16, 91 0, 099 111, 7 8, 65 321, 0 -0, 403 | 5s25p65d106s2 0, 160 10, 44 18, 75 0, 112 61, 5 13, 546 -38, 89 356, 66 0, 850 |
Другой метод восстановления цинка заключается в электролитическом выделении его из сульфата. Последний получается обработкой обожженных концентратов серной кислотой.
Цинк – голубовато-серебристый металл. При комнатной температуре он довольно хрупок, но при 100-150 0С он хорошо гнется и прокатывается в листы. При нагревании выше 2000С цинк становится очень хрупким. На воздухе он покрывается тонким слоем оксида или основного карбоната, предохраняющим его от дальнейшего окисления. Вода почти не действует на цинк, хотя он и стоит в ряду напряжений значительно раньше водорода. Это объясняется тем, что образующийся на поверхности цинка при взаимодействии его с водой гидроксид практически нерастворим и препятствует дальнейшему течению реакции. В разбавленных же кислотах цинк легко растворяется с образованием соответствующих солей. Кроме того, цинк, подобно бериллию и другим металлам, образующим амфотерные гидроксиды, растворяется в щелочах. Если сильно нагреть цинк в атмосфере воздуха, то пары его воспламеняются и сгорают зеленовато-белым пламенем, образуя ZnO.
Применение цинка очень разнообразно. Значительная часть его идет на нанесения покрытий на железные и стальные изделия, предназначенные для работы в атмосферных условиях или в воде. При этом цинковые покрытия в течение многих лет хорошо защищают основной металл от коррозии. Однако в условиях высокой влажности воздуха при значительных колебаниях температуры, а также в морской воде цинковые покрытия неэффективны. Широкое промышленное использование имеют сплавы цинка с алюминием, медью и магнием. С медью цинк образует важную группу сплавов – латуни. Значительное количество цинка расходуется для изготовления гальванических элементов.
Механические и коррозионные свойства цинка зависят от присутствия в нем небольших количеств примесей других металлов. Например, примесь железа повышает хрупкость цинка и его сплавов и затрудняет их обработку, а также резко увеличивает скорость коррозии цинка в кислотах. Поэтому высококачественные сплавы цинка содержат очень малые количества примесей других металлов. Например, примесь свинца не должна превышать 0, 01%, а железа – 0, 1%.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. На медных предметах нередко можно видеть зеленый налет гидроксокарбоната меди Cu(OH)2CO3. Составить уравнение реакции образования соли.
2. Составить уравнения реакций:
а) ZnS + O2 ®
б) HgS + O2 ®
в) Zn + HNO3(конц) ®
3. Составить уравнения реакций последовательного получения следующих веществ: Cd(NO3)2 ® CdO ® Cd ® CdCl2 ® Cd(OH)2 ® [ Cd(NH3)4] (OH)2.
4. Как взаимодействует цинк с водой?
5. Сравнить химическую активность меди и цинка.
26. Общая характеристика металлов побочной подгруппы VI группы. Хром.
Побочная подгруппа VI группы, или подгруппа хрома, представлена тремя элементами: хромом, молибденом и вольфрамом. К этой же подгруппе относится и 106-й элемент (экавольфрам), полученный искусственно в 1974 г. Металлы подгруппы хрома входят в состав четных рядов больших периодов и относятся к d-элементам, так как в их атомах происходит заполнение d-подуровня предвнешнего уровня 1— 10 электронами. На внешнем уровне у атомов d-элементов содержится 1 или 2 электрона.
Cr 1s22s2 2p6 3s23p64s13d5 (4 ряд, 4-й период)
Mo 1s22s2 2p6 3s23p64s23d104p65s14d5 (6 ряд, 5-й период)
W 1s22s22p63s23p64s23d104p65s24d105p66s24f145d4 (8 ряд, 6-ой период)
У хрома и молибдена на d-подуровне по 5 электронов, а у вольфрама—четыре. На внешнем уровне у хрома и молибдена вследствие «провала» электрона с внешнего на d-подуровень предвнешнего уровня содержится один электрон (а), а у вольфрама—два (б).
ns 6s
(n-1)d 5d ¯
а б
Электронная стуртура d-подуровня Электронная структура d- подуровня
предвнешнего уровня и s-подуровня предвнешнего s-подуровня внешнего
внешнего уровня атомов хрома и уровня вольфрама 5d46s2
молибдена d5 s1
Хром, молибден и вольфрам проявляют максимальную степень окисления в соединениях +6, но для хрома и молибдена характерны соединения, в которых они имеют более низкую степень окисления (для молибдена +4, для хромa +3 или +2). Хром и его аналоги водородных соединений не образуют. Строение внешней и предвнешней оболочек свидетельствует о принадлежности этой подгруппы элементов к металлам.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
ХРОМ 5224 Сr
Минерал, содержащий хром, был открыт в 1766 г. И. Г. Ломанном и назван «сибирский красный свинец». В настоящее время этот минерал известен под названием крокоита РЬСг04. В 1797 г. французский химик Л. Н. Вокелен впервые выделил металлический хром.
Нахождение в природе. Содержание хрома в земной коре составляет 8, 3-10-3 % по массе. Важнейшим сырьевым минералом для получения хрома служит хромистый железняк FeО-Сг2Оз. Кроме красной свинцовой руды, в природе встречается также хромовая охра Сг2 0з.
Физические свойства. Хром — белый, с сероватым оттенком, блестящий металл, обладающий большой твердостью и хрупкостью; температура плавления около 1890°С. При комнатной температуре устойчив к действию воды и воздуха благодаря оксидной пленке, защищающей его от окисления
Химические свойства. Хром является восстановителем.
В зависимости от условий реакции окисляется до Сг+2, Сг+3, и Сг+6. Наиболее устойчивы соединения, где он проявляет степени окисления +2 и +3. С кислородом взаимодействует лишь при нагревании. В этих же условиях хром реагирует c хлоpом, сеpой. азотом, кpемнием:
4Cr + 3O2 = 2Cr2O3
t
2Cr + 3Cl2 = 2CrCl3
Обычно на поверхности хрома имеется плотный слой оксида Сг2О3, предохраняющий металл от дальнейшего окисления. При обычных температурах такая пассивированная поверхность предотвращает взаимодействие хрома с азотной кислотой и царской водкой. На холоду хром реагирует с разбавленной хлороводородной кислотой с выделением водорода и образованием солей хрома +2. Последние быстро окисляясь кислородом воздуха переходят в соли хрома +3.
Cr + 2HCl = CrCl2 + H2
4CrCl2 + O2 + 4HCl = 4CrCl3 + 2H2O
При повышении температуры или концентрации соляной кислоты, а с разбавленной серной кислотой в любом случае хром окисляется до Сг+3.
Получение. Для получения металлического хрома используют хромистый железняк. Его сплавляют с содой в присутствии кислорода, а образующийся хромат натрия восстанавливают углеродом (коксом) до оксида хрома (111):
t
4FeO × Cr2O3 + 7O2 + 8Na2CO3 = 8Na2CrO4 + 2Fe2O3 + 8CO2
3C + 2Na2CrO4 + 3CO + 2Na2O + Cr2O3
Далее восстановлением оксида хрома (III) алюминием получают металлический хром:
Cr2O3 + 2Al = Al2O3 +2 Cr
Применение. В современном машиностроении хром получил широкое применение как легирующий компонент сталей, никелевых и медных сплавов. В инструментальных сталях для повышения прочности хром применяется в качестве добавки. Если содержание хрома в стали превышает 10%, сталь обладает большей устойчивостью к окислению и коррозии.
Соединения хрома
С кислородом хром образует ряд оксидов: СгО, Сг2О3, СгО3. Наиболее устойчив из них оксид хрома (III) Сг2О3.
Оксид хрома (II) СгО обладает основными свойствами. При взаимодействии с хлороводородной кислотой образуется хлорид хрома (II):
CrO + 2HCl = CrCl2 + H2O
Если на хлорид хрома (II) подействовать раствором щелочи, то выпадает желтый осадок Сг(ОН)2:
CrCl2 + 2NaOH = Cr(OH)2 ¯ + 2NaCl
Соединения хрома (II) неустойчивы и быстро окисляются до соединений хрома (III):
2CrCl2 + 2H2O = 2CrOHCl2 + H2
Оксид хрома(Ш) Сг2О3 относится к амфотерным оксидам. В обычных условиях это порошок зеленого цвета. Он не растворяется в воде и слабо растворяется в щелочах и кислотах. Получают Сг2О3 прокаливанием оксида хрома (VI), разложением дихромата аммония, а также термическим разложением гилооксила хрома(III):
t
4CrO3 = 2Cr2O3 + 3O2
t
(NH4)2Cr2O7 = N2 + 4H2O + Cr2O3
t
2Cr(OH)3 = 3H2O + Cr2O3
Оксид хрома (III) применяется в промышленности для получения металлического хрома, а также используется для приготовления масляных и акварельных красок.
При сплавлении оксида хрома (III) со щелочами или содой образуются мета- или ортохромиты, являющиеся солями соответствующих кислот—НСrО2 (метахромистая) и Н3CrO3 (ортохромистая):
t
Cr2O3+2NaOH=2NaCrO2+H2O
t
Cr2O3+6NaOH=2Na3CrO3+3H2O
Гидроксид хрома(1П) Сг(ОН)3 образуется при действии щелочей на соли хрома, выпадает в виде синевато-серого осaдка:
CrCl3 + 3NaOH = Cr(OH)3¯ + 3NaCl
Гидроксид хрома (III) Сг(ОН)3 обладает амфотерными свойствами. Подобно гидроксиду алюминия, взаимодействует с кислотами с образованием солей Сг +3, а со щелочами - с образованием хромитов:
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
Cr(OH)3 + NaOH = NaCrO2 + 2H2O
Следовательно, гидроксид хрома (III) можно рассматривать и как основание, и как кислоту:
Cr3+ + 3OH- «Cr(OH)3º H3CrO3 «HCrO2 + H2O «H+ + CrO2 - + H2O
Под действием окислителей в щелочной среде соединения хрома (III) переходят в соединения хрома (VI), при этом происходит изменение зеленой окраски раствора в желтую:
2NaCrO2 + 3Br2 + 8NaOH = 2Na2CrO4 + 6NaBr + 4H2O
Oксид xpoмa (Vl) СгО3 является типичным кислотным оксидом. Легко растворяется в воде с образованием растворов хромовой Н2Сг04 и двухромовой Н2Сг207 кислот. В растворе между этими двумя кислотами устанавливается равновесие:
2H2CrO4 «H2Cr2O7 + H2O
Добавление к раствору кислоты смещает равновесие вправо, добавление щелочей—влево. На этом основано получение хроматов из бихроматов и наоборот:
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
2K2CrO4 + H2SO4 = K2SO4 + K2Cr2O7 + H2O
Соли хромовых кислот в кислой среде являются сильными окислителями,
при этом Сг+6 восстанавливается до Сг+3 с изменением оранжевой окраски раствора на зеленую:
K2Cr2O7 + 3K2SO3 + 4H2SO4 = Cr2(SO4)3 + 4K2SO4 + 4H2O
K2Cr2O7 + 6KJ + 7H2SO4 = Cr2(SO4)3 + 3J2 + 4K2SO4 + 7H2O
Равные объемы насыщенного на холоду раствора К2Сг207 и концентрированной серной кислоты образуют так называемую хромовую смесь, обладающую высокой окислительной способностью.
Основная хромовая руда—хромит—используется в производстве химически пассивных и термостойких огнеупорен (магнезиохромитовые кирпичи). Бихроматы и хромовые квасцы КСг(S04)2 применяются для дубления кож. Из хромата свинца РЬСг04 изготовляют красители.
Все соли хромовых кислот ядовиты.
27. Общая характеристика металлов побочной подгруппы
VII группы.Марганец.
Побочная подгруппа VII группы, или подгруппа марганца, состоит из марганца, технеция и рения. Сюда же отнесен синтезированный в 1976 г. элемент с Z-107, химические свойства которого сопоставимы с таковыми элементов подгруппы марганца.
Элементы подгруппы марганца входят в состав четырех рядов 4, 5, 6 и 7-го периодов и относятся к d-элементам. На внешнем уровне у них по два s-электрона, а на d-подуровне предвнешнего уровня 5 неспаренных электронов, следовательно, конфигурация валентных электронов (п—1) d5ns2.
Таким образом, пять d-электронов предвнешнего уровня вместе с двумя s-электронами внешнего уровня могут принимать участие в образовании химической связи, следовательно, максимальная валентность атомов этих элементов 7.
Mn 1s22s22p63s23p64s23d5 (4-й период)
Te 1s22s22p63s23p64s23d104p65s24d5 (5-й период)
Re 1s22s22p63s23p64s23d104p65s24d105p66s24f145d5 (6-й период)
Однако в зависимости от того, сколько электронов внешнего и предвнешнего уровней принимает участие в образовании химической связи, валентность этих элементов может составлять от 1 до 7. Наиболее устойчивыми являются соединения, в которых валентность соответствует 2, 4 и 7. Элементы подгруппы марганца проявляют переменную степень окисления: марганец и рений +2, +3, +4, +6, +7 (соединения марганца со степенью окисления +1 и +5 неустойчивы), технеций +4, +6, +7.
МАРГАНЕЦ 55 25Мп
Марганец впервые получили К. В. Шееле и Ю.Ган в 1774 г. при исследовании минерала пиролюзита.
Нахождение в природе. Марганец широко распространен в природе. Его содержание в земной коре составляет 0, 1% по массе. Важнейшие соединения—оксиды, образующие различные минералы: оксид марганца (IV) МпО2 (пиролюзит и манганомелан); оксид марганца (III) Мп2О3 (браунит); оксид марганца (II, III) Мп304 (гаусманит); карбонат марганца (II) МпСО3 (родохрозит).
Физические свойства. По своему внешнему виду марганец напоминает железо, но в отличие от последнего намного тверже и более хрупок, характеризуется аномально низкой электрической проводимостью. Плавится марганец при температуре 1245°С.
Для марганца характерны полиморфные модификации, образующиеся при различных температурных режимах.
Химические свойства. Марганец относится к активным металлам. Обычно он покрыт прочной пленкой оксида, которая предохраняет металл от дальнейшего окисления. В измельченном состоянии марганец легко взаимодействует с кислородом:
Mn + O2 = MnO2
Активно реагирует с галогенами, азотом, углеродом, фосфором и кремнием. Присоединение галогенов и азота сопровождается горением:
t
3Mn + N2 = Mn3N2
В электрохимическом ряду напряжений марганец находится намного левее водорода (между алюминием и цинком), поэтому способен активно вытеснять водород из соединении. Порошкообразный марганец при нагревании вытесняет водород из воды:
Mn + 2H2O = Mn(OH)2 + H2
При взаимодействии с разбавленными кислотами (кроме HNO3 и концентрированной H2S04) марганец легко вытесняет водород, окисляясь до Мп+2:
Mn + 2HCl = MnCl2 + H2
Реакция с концентрированными серной и азотной кислотами сопровождается выделением продуктов восстановления этих кислот
3Mn + 8HNO3 = 3Mn(NO3)2 + 2NO + 4H2O
Mn + 2H2SO4 = MnSO4 + SO2 + 2H2O
Эти процессы возможны только при нагревании, так как на холоду указанные кислоты пассивируют металл.
При взаимодействии с солями металлов, стоящих в ряду активности правее, марганец вытесняет металлы:
Mn + CuSO4 = MnSO4 = Cu
Получение. Чистый марганец получают электролизом хлорида или сульфата. Такой продукт содержит значительное количество примесей, от которых избавляются путем повторной очистки. Марганец также получают методом алюминотермии:
t
4Al + 3MnO2 = 2Al2O3 + 3Mn
При восстановлении углем оксидов марганца образуется так называемый ферромарганец, характеризующийся высоким содержанием углерода и железа (70—90% Mn).
Применение. Перманганат калия находит широкое применение как энергичный окислитель. Разбавленные растворы используются в медицинской практике в качестве дезинфицирующего средства.
Главный потребитель чистого марганца — сталелитейное производство. Введение в состав сталей марганца в сочетании с другими легирующими добавками придает стали твердость и износоустойчивость, не снижая при этом пластичности.
Для человеческого организма марганец—незаменимый микроэлемент. Он влияет на рост и кроветворение. Особая роль принадлежит марганцу в синтезе жирных кислот и холестерина из уксусной кислоты. Он оказывает влияние на синтез гликогена, усиливает влияние инсулина. Марганец пролонгирует действие многих витаминов (А, Е, В, Bi, Be и др.). Его влияние на обмен веществ усиливается при введении в организм вместе с медью и цинком. Недостаточность марганца сопровождается нарушением образования костной ткани, расстройством координации движений, параличом. В больших концентрациях марганец ядовит.
Соединения марганца
Марганец образует четыре простых оксида (MnO, Mn2O3, MnO2 и Mn2O7) и смешанный оксид Mn3O4 (или MnO × Mn2O3). Первые два оксида обладают основными свойствами, диоксид марганца MnO2 амфотерен, а высший оксид Mn2O7 является ангидридом марганцовой кислоты HMnO4. Известны также производные марганца (VI), но соответствующий оксид MnO3 не получен.
В практическом отношении наиболее важны соединения марганца (II), диоксид марганца и соли марганцовой кислоты - перманганаты, в которых марганец находится в степени окисленности +7.
С о е д и н е н и я м а р г а н ц а (II). Соли марганца (II) получаются при растворении марганца в разбавленных кислотах или при действии кислот на различные природные соединения марганца. Так, из раствора, остающегося после получения хлора действием соляной кислоты на диоксид марганца, выкристаллизовывается хлорид марганца (II) MnCl2 в виде бледно-розовых кристаллов. В твердом виде соли марганца (II) обычно розового цвета, растворы же их почти бесцветны.
При действии щелочей на растворы солей марганца (II) выпадает белый осадок – гидроксид марганца (II) Mn(OH)2. Осадок легко растворяется в кислотах. На воздухе он быстро темнеет, окисляясь в бурый гидроксид марганца (IV) Mn(OH)4.
Оксид марганца (II), или закись марганца, MnO получается в виде зеленого порошка при восстановлении других оксидов марганца водородом.
С о е д и н е н и я м а р г а н ц а (IV). Наиболее стойким соединением марганца является темно-бурый диоксид марганца MnO2; он легко образуется как при окислении низших, так и при восстановлении высших соединений марганца. Как уже указывалось, MnO2 - амфотерный оксид; однако и кислотные, и основные свойства выражены у него очень слабо.
В кислой среде диоксид марганца – довольно энергичный окислитель. В качестве окислителя его применяют при получении хлора из соляной кислоты и в сухих гальванических элементах. Соли марганца (IV), например MnCl4 и Mn(SO4)2, весьма нестойки.
С о е д и н е н и я м а р г а н ц а (VI) и (VII). При сплавлении диоксида марганца с карбонатом и нитратом калия получается зеленый сплав, растворяющийся в воде с образованием красивого зеленого раствора. Из этого раствора можно выделить темно-зеленые кристаллы манганата калия K2MnO4 - соли марганцовистой кислоты H2MnO4, очень нестойкой даже в растворе.
Перманганат калия KMnO4 - наиболее широко применяемая соль марганцовой кислоты. Кристаллизуется он в виде красивых темно-фиолетовых, почти черных призм, умеренно растворимых в воде. Растворы KMnO4 имеют темно-малиновый, а при больших концентрациях – фиолетовый цвет, свойственный ионам MnO4-. Как и все соединения марганца (VII), перманганат калия – сильный окислитель. Он легко окисляет многие органические вещества, превращает соли железа (II) в соли железа (III), сернистую кислоту окисляет в серную, из соляной кислоты выделяет хлор и т.д.
Вопросы и задачи:
1. Составьте электронные формулы хрома и марганца. Объясните почему Мn
отнесли к металлам?
2. Дайте характеристику окислительно-восстановительных свойств различных
соединений хрома и марганца.
3. Объясните устойчивость марганца на воздухе и в воде
4. Составьте уравнение реакции
а) K2Cr2O7 + H2SO4 + Na2 SO3 ® Na2SO4+...
б) реакция на ионы СrO42- и Сr2 O72-
в) окисление иона [ Cr(OH)6] в бромом в кислой среде.
5. Составьте уравнение реакции:
а)Mn(OH)2+ O2+ H2 O ® ….
б)MnO2 + KNO3 + KOH ® K2 MnO4+ …
28. ЖЕЛЕЗО 56 26Fe.
Железо относится к металлам, известным человечеству с глубокой древности. Первыми металлами, применявшимися еще в Древнем Египте, были медь, золото, свинец, олово и железо.
Русское название происходит от санскритского корня «жель», что означает «блестеть», «пылать».
Нахождение в природе. Железо—один из самых распространенных металлов. Его содержание в земной коре достигает 4, 66% по массе. В свободном состоянии железо найдено лишь в метеоритах (так называемое никелистое метеоритное железо). В природных условиях оно встречается преимущественно в виде соединений, образуя залежи железных руд. Важнейшие минералы, включающие железо, —это магнитный железняк, или магнетит Fe204 (Fe2O3 -FeO); красный железняк, или гематит F2O3; бурый железняк, или лимонит Fe2О3-Н2О; железный шпат, или сидерит FeCO3; железный колчедан, или пирит FeS2
Физические свойства. Химически чистое железо представляет собой блестящий, серебристо-белый пластичный металл. Значительно мягче золота и серебра. Легко подвергается ковке, прокатке и другим видам обработки в горячем и холодном состояниях. Температура плавления 1539°С. Обладает магнитными свойствами, хорошей электро- и теплопроводностью.
Химические свойства. Железо относится к металлам со средней восстановительной активностью. В электрохимическом ряду напряжений металлов располагается после цинка.
В обычных условиях железо очень медленно окисляется кислородом воздуха, однако накаленное железо легко сгорает с образованием оксида железа (III):

В присутствии влаги окисление железа на воздухе происходит быстрее и оно ржавеет, т. е. покрывается слоем гидpатиpованного оксида железа (III):
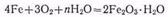
В присутствии следов влаги железо легко окисляется хлором, образуя хлорид железа (III):
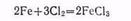
Окисление железа слабыми окислителями приводит к образованию Fe(+), а силньыми — Fe(+3).
С водородом железо не реагирует.

При температуре 700 °С оксид железа (II) восстанавливается ло металлического железа:

Соединения кремния, марганца и фосфора, содержащиеся в железных рудах в виде примесей, также восстанавливаются:

Так называемую пустую породу в руде составляет главным образом диоксид кремния. Чтобы перевести такие тугоплавкие примеси в более легкоплавкие соединения, к руде добавляют флюсы. В качестве флюса используется карбонат кальция СаСОз. Кремнистые примеси, содержащиеся в руде, взаимодействуют с оксидом кальция, образующимся при разложении СаСО3:
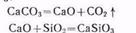
В свою очередь СаSiOз легко отделяется в виде шлака. Приведенные реакции протекают в доменной печи, поэтому процесс получил название доменного. Схема доменного процесса приведена на рис. 54.
Продукт, получающийся в результате доменного процесса, называется доменным чугуном; он содержит 3—4% углерода, а также примеси кремния, серы, фосфора и марганца. Чугун хрупок, не поддается ковке и прокатке, бывает нескольких сортов: белый, серый, специальный и т. д.
В сером чугуне углерод находится в виде свободного графита, в форме тончайших пластинок; этот чугун применяется для литья.
Белый чугун содержит карбид железа, называемый цементом. Этот чугун очень тверд и хрупок и обычно применяется для получения стали. Добавка к чугуну фосфора делает его более текучим. Это свойство широко используется для художественного литья из чугуна.
Сталь представляет собой сплав железа с углеродом, содержащий очень малые количества тех же примесей, что и серый чугун. Содержание углерода в стали может колебаться от 0, 1 до 1, 5%. С увеличением содержания углерода прочность сталей возрастает. Исходным сырьем для получения сталей служит доменный чугун. В промышленности для переработки чугуна в сталь применяют в основном бессемеровский и мартеновский процессы, а также варку стали в электропечах.
|
|
