
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Белок-инициатор DnaA
|
|
Белок DnaA играет ключевую роль в инициации репликации хромосомы у многих бактерий. Он последовательно выполняет 3 главные функции: 1) узнает область начала репликации oriC, последовательно связываясь с нонамерными повторами в ДНК – блоками DnaA; 2) способствует расплетанию легкоплавких АТ-богатых участков ДНК oriC; 3) вербует на расплетенные участки oriC ДНК-геликазу DnaB.
У E. coli белок DnaA имеет длину 467 остатков (рис. 3.1) и состоит из 4 определяемых гомологией доменов (I-IV), каждый из которых в разной степени участвует в инициации репликации на oriC. Наиболее консервативными среди бактериальных белков DnaA являются домены III и IV (остатки 130-350 и 351-367 соответственно). Несколько меньше гомология в N-концевом домене I (остатки 1-56), а домены II (остатки 57-129 у E. coli) белков DnaA у разных бактерий сильно различаются по длине и аминокислотной последовательности и иногда рассматриваются как неконсервативные гибкие линкеры, так как вставки или делеции в большей части домена II не влияют на функции.
Все белки DnaA имеют модульную структуру. Первые 86 остатков DnaA образуют домен олигомеризации, состоящий из гептадных повторов гидрофобных остатков. Этот домен участвует в образовании мультимерных комплексов белка DnaA на ДНК oriC. Он может обеспечивать и димеризацию других белков. Так, слияние домена олигомеризации DnaA с N-концевым доменом связывания с ДНК репрессора CI фага l придает химерному белку способность к димеризации. Домен олигомеризации DnaA перекрывается с частью домена, связывающего геликазу DnaВ (остатки 24-86). В физическом контакте с DnaВ участвуют также остатки 136-148 белка DnaA. Впрочем, считается, что для эффективной функции погрузки на oriС белка DnaВ требуются почти все области DnaA.
Центральный домен III имеет открытую изогнутую структуру ab, типичную для связывающих нуклеотиды белков, и содержит контактный участок для связывания нуклеотидов (остатки 168-236), критическую роль в котором играет остаток лиз178. Белок DnaA может связывать АТФ и АДФ. Связывание АТФ вызывает изменение конформации DnaA. Комплекс DnaA-АТФ абсолютно необходим для инициации репликации и является функционально активным, в отличие от неактивного комплекса с АДФ. Весь домен III обладает характеристической АТФазной активностью, но она низка и требует стимуляции другими белками. Этот домен необходим для локального расплетания ДНК в АТ-богатых областях oriC. Однако гидролиз АТФ не требуется для активности DnaA, и АТФ можно заменить на его негидролизуемый аналог АТФgS.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Короткий участок в начале домена IV (остатки 372-381) участвует в регуляторных взаимодействиях DnaA с кислыми фосфолипидами клеточной мембраны. Большая часть домена IV (остатки 374-467) необходима и достаточна для специфического связывания с ДНК. В таком связывании белок DnaA узнает консервативные участки ДНК длиной 9 п.н. – “блоки DnaA” c консенсусной последовательностью 5’-ТТАТ(C/А)САСА. С этими блоками белок DnaA может взаимодействовать кооперативно и образовывать мультимерные комплексы за счет белок-белковых взаимодействий. Домен связывания с ДНК состоит из трех a-спиралей: амфипатических спиралей А и В с основной петлей между ними и длинной спирали С. Мутации во всех этих участках домена связывания с ДНК могут нарушать ассоциацию DnaA с ДНК. Мутации, затрагивающие первые 12 остатков на N-конце спирали С изменяют специфичность узнавания последовательности блока DnaA.



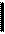

 1 56 129 350 429
1 56 129 350 429




 N I II III IV C
N I II III IV C

 1 6
1 6


 2 2 5
2 2 5
 3
3
 4
4
Рис. 3.1. Структура белка DnaA E. coli.
I-IV - области гомологии бактериальных белков DnaA; 1 – домен олигомеризации, 2 – области связывания с геликазой DnaВ, 3 – сайт связывания нуклеотидов, 4 – домен АТФазной активности, 5 – участок взаимодействия с мембранными фосфолипидами, 6 – домен связывания с ДНК.
|
|
