
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Этапы инициации репликации на ОНР oriC
|
|
Для инициации репликации в ОНР oriC необходимо, чтобы матрица ДНК находилась в сверхскрученной кольцевой форме. Первой стадией инициации является образование начального “преинициирующего” комплекса, в котором белок DnaA в мономерной форме связывается с 4 более сильными из 5 блоков DnaA (R1-R4). Связывание DnaA вызывает изгибание ДНК на 40о в каждом из этих блоков (рис. 3.3). Первичный комплекс содержит также белок Fis, ассоциированный с узнаваемым им сайтом рядом с нонамером R2. Дальнейшая сборка комплекса инициации требует кооперативной мультимеризации многих молекул белка DnaA. Предполагается, что Fis ингибирует продвижение инициации до тех пор, пока на oriC не соберется достаточный набор молекул DnaA.
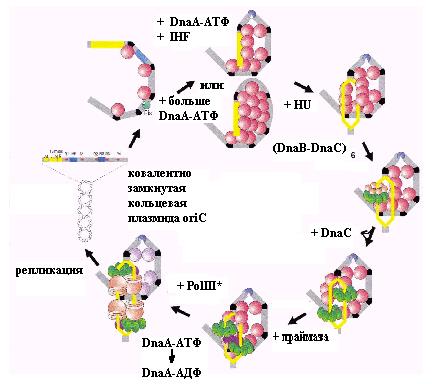
Рис. 3.3. Цикл инициации репликации хромосомы E. coli
После этого белок Fis покидает область oriC, белок DnaA прочно связывается со слабым сайтом R3, и в комплекс входит фактор IHF, который вызывает очень сильное изгибание ДНК. Такой же эффект достигается в отсутствие IHF при более высокой концентрации DnaA. В результате образуется искривленный компактный нуклеопротеиновый комплекс ДНК oriC, содержащий около 20 молекул DnaA. В присутствии ещё одного гистоноподобного белка HU при высокой концентрации АТФ (более 20 мМ) и при физиологической температуре (37о) образуется “открытый” комплекс инициации, в котором расплетаются АТ-богатые области на левом фланге oriC. В этом процессе должна участвовать активная форма DnaA-АТФ, но гидролиз связанного АТФ не происходит, так что его энергия не используется для расплетания нитей ДНК. Возможно, причиной локального плавления ДНК являются напряжения, возникающие в нуклеопротеиновом комплексе с DnaA-АТФ. Расплетание начинается в правом 13-мере R, а затем распространяется на элементы L и М.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Следует учесть также, что в процессе расплетания ДНК участвуют дополнительные сайты связывания белка DnaA в АТ-богатых участках ДНК, названные пентамерными блоками DnaA-АТФ и имеющие консенсусную последовательность 5’-AGatct. Эти сайты имеют очень низкое сродство к DnaA-АТФ в днДНК и гораздо более высокое сродство в расплетенной онДНК. Высказано предположение, что вначале DnaA-АТФ связывается с высоким сродством с сайтом R1 в днДНК, и из этой якорной области начинается кооперативное связывание DnaA-АТФ с соседними пентамерными блоками. Это приводит к дестабилизации двойной спирали в АТ-богатой области 13-меров и её расплетанию. Разошедшиеся одиночные нити ДНК стабилизируются комплексом DnaA-АТФ, имеющим к ним высокое сродство. В момент начала расплетания с областью oriC связываются 18 мономеров DnaA-АТФ, но в открытом комплексе число связанных комплексов DnaA-АТФ увеличивается до 24-30 за счет взаимодействия с однонитевыми расплетенными участками. Расплавленная область вначале имеет длину 28 п.н., но затем онДНК покрывается белком SSB, и длина области денатурации ДНК увеличивается до 44-46 п.н.
Частичное плавление ОНР служит предпосылой для связывания ДНК-геликазы DnaВ, которая вербуется на свободную от белка SSB онДНК в составе комплекса с её погрузчиком DnaС (см. раздел 2.1). В вербовке этого двойного гексамера на oriC участвует сам связанный с ДНК белок DnaA, который взаимодействует N-концевым доменом I с центральной b-областью DnaВ и центральным доменом III с N-концом DnaВ. Для погрузки геликазы DnaВ требуется почти весь белок DnaA, но связывание АТФ с DnaA не является обязательным.
С начальным однонитевым пузырьком ДНК длиной 44 н. связываются два гексамера DnaВ-DnaС и увеличивают его длину до 65 н. Гидролиз АТФ в этом комплексе вызывает освобождение DnaС и активацию геликазной активности DnaВ. В результате с расплавленным АТ-богатым участком oriC оказываются связанными два активных гексамерных DnaВ – по одному на 5’-стороне каждой из разошедшихся нитей ДНК. Это, вероятно, обусловлено существованием двух разнонаправленных триад сайтов связывания DnaA-АТФ в каждой из двух нитей и, в конечном итоге, приводит к сборке на ОНР oriC двух дивергентно ориентированных репликативных вилок. Два геликазных комплекса движутся по комплементарным нитям ДНК в направлении 5’®3’ друг мимо друга и взаимодействуют с праймазой DnaG, которая синтезирует затравки РНК вначале для ведущих, а затем отстающих нитей двух разнонаправленных репликативных вилок (рис. 3.4). На праймированных сайтах собираются два скользящих зажима b-субъединиц ДНК-полимеразы III и два димера ее каталитических a-субъединиц. Таким образом, инициация репликации ДНК на oriC завершается образованием двух движущихся в противоположных направлениях репликативных вилок.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
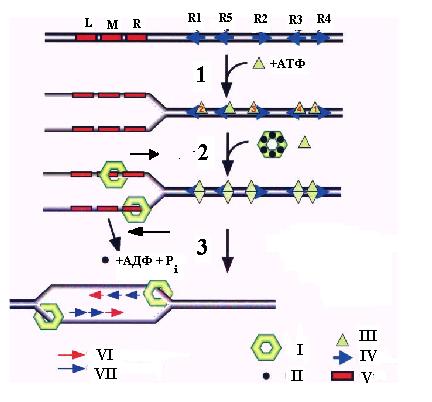
Рис. 3.4. Этапы образования двух разнонаправленных репликативных вилок при инициации репликации в области oriC хромосомы E.coli.
1 – связывание белка DnaA, 2 – связывание двойного гексамера DnaВ-DnaС, 3 – погрузка колец белка DnaВ и геликазы DnaG и синтез праймеров для ведущей и отстающей нитей двух репликативных вилок.
I – гексамер DnaВ, II – мономер DnaС, III – белок DnaА, IV - блоки DnaА, V – 13-меры, VI – праймеры для ведущей нити (для репликативных вилок, движущихся влево или вправо - на верхней и нижней матричных нитях соответственно), VII – праймеры для отстающей нити (для репликативных вилок, движущихся влево или вправо - на нижней и верхней матричных нитях соответственно).
|
|
