
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
RNAP Toprim
|
|
Рис. 2.18. Доменная организация праймазы DnaG E. coli.
I – домен связывания с ДНК, II – центральный каталитический домен, III - линкерный домен, IV – домен взаимодействия с другими белками.
1-6 – консервативные участки бактериальных и фаговых праймаз, RNAP – участок гомологии с РНК-полимеразами, Toprim - область гомологии с ДНК-топоизомеразами
Рентеноструктурный анализ белка DnaG не обнаружил структурного сходства с известными РНК-полимеразами, но подтвердил основанную на первичной последовательности гомологию праймазы с ДНК-топоизомеразами. Центральная часть каталитического домена DnaG имеет укладку типа Toprim, характерную для топоизомераз классов 1 и 2 (см. 2.5). Этот домен имеет форму гребня и содержит центральную b-слой, окруженную несколькими a-спиралями (рис. 2.19). На вершине этой структуры находятся остатки асп, связывающие Mg2+ и необходимые для катализа. Впадина домена Toprim может слабо связывать дуплекс ДНК-РНК длиной 10 п.н. В этом канале расположен и остаток лиз241 из сегмента RNAP гомологии с РНК-полимеразами. Домен II через гибкий линкерный домен III в области остатка 400 соединен с уникальным для бактериальных праймаз С-концевым доменом IV. Последний участвует во взаимодействиях белка DnaG с другими компонентами аппарата репликации. В частности, последние 16 С-концевых остатков DnaG необходимы для взаимодействия с N-концевым доменом ДНК-геликазы DnaВ и участвуют в вербовке DnaG в репликативную вилку. Прямой физический контакт с DnaВ обеспечивает попадание расплетенной геликазой нити ДНК сразу к активному центру DnaG и стимулирует праймазную активность.
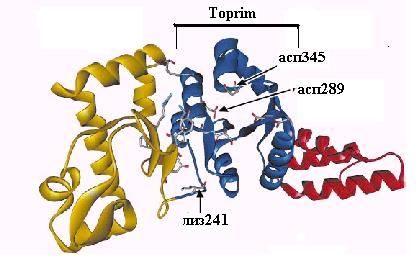
Рис. 2.19. Трехмерная структура активного фрагмента праймазы DnaG E. coli
с разрешением 2, 9 Å.
Отмечены положения домена Toprim гомологии с топоизомеразами и остатков активного центра праймазы.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Эукариотические праймазы являются интегральными компонентами бифункционального фермента ДНК-полимераза a -праймаза (см. 1.00) и состоят из 2 субъединиц р55 и р48 с мол. м. 55 и 48 кД (у человека). Белки р55 и р48 образуют прочно ассоциированный комплекс, в формировании которого участвуют N- и C-концевые домены р55. Субъединица р55 имеет сигнал ядерной локализации и способна направлять субкомплекс р55-р48 в ядро независимо от полимеразного субкомплекса. Субъединица р55 участвует в ассоциации праймазного субкомплекса с главной субъединицей р180 ДНК-полимеразы a. Кроме того, белок р55 может связываться с онДНК и с дуплексом ДНК-РНК, образовавшися после синтеза праймерной РНК.
Каталитической субъединицей праймазы является белок р48, который связывается с онДНК и катализирует образование фосфодиэфирных связей в РНК. Кристаллическая структура этой субъединицы пока не установлена.Однако есть основания полагать, что белок р48 относится к тому же семейству Х нуклеотидилтрансфераз, что и ДНК-полимераза b. Гомология последовательностей праймазы р48 и ДНК-полимеразы b позволяет предположить, что праймаза имеет конформацию кисти руки и содержит в субдомене ладони каталитическую триаду остатков асп109, асп111 и асп306, связывающих Mg2+. Таким образом бактериальные и эукариотические праймазы не похожи друг на друга ни по первичной, ни по третичной структуре. Тем не менее, сохранение триад кислых остатков показывает, что молекулярный механизм каталитической стадии у этих двух типов геликаз одинаков и состоит в опосредованной 2 катионами Mg2+ нуклеофильной атаке 3’-гидроксила растущего конца РНК на фосфодиэфирную связь в рНТФ, как и в случае ДНК-полимераз и типичных РНК-полимераз.
Праймаза DnaG инициирует синтез затравок РНК преимущественно (в 60% случаев) на тринуклеотидном сайте 3’-GTC в матричной нити ДНК. В геноме E. coli имеются 205 тысяч таких сайтов на среднем расстоянии»23 н. друг от друга, чего достаточно для быстрой инициации синтеза РНК всех фрагментов Оказаки. Праймазы фагов Т7 и Т4 инициируют синтез праймерных РНК на других триплетах: 3’-T(C/T)G 3’-GTC соответственно. Различная специфичность этих праймаз частично объясняется разной структурой петли длиной 17 н. в мотиве цинкового пальца.
Первый остаток G в сайте инициации существенен только для узнавания стартового сайта белком DnaG и не используется для включения нуклеотида в РНК. Синтез праймерной РНК de novo начинается на напротив второго остатка Т. На растущем 3’-конце РНК вначале образуется динуклеотид AG. Эта стадия, как и при инициации транскрипции РНК-полимеразами, является лимитирующей скорость синтеза праймера. Последующие 10 фосфодиэфирных связей образуются гораздо быстрее, и праймаза DnaG синтезирует затравку РНК длиной 11±1 н. Этот размер примерно соответствует длине гибрида ДНК-РНК, помещающегося в полости молекулы DnaG. Затем праймаза переходит в дистрибутивную моду и синтез РНК замедляется или прекращается. Обычно это сопровождается вытеснением праймазы с матрицы ДНК, механизм которого мы рассмотрим в главе 4. Короткая затравка РНК предается к ДНК-полимеразе III, которая синтезирует ДНК фрагмента Оказаки. Для эффективного синтеза РНК праймаза DnaG нуждается в физическом контакте с ДНК-геликазой DnaВ.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Аналогично идет синтез праймерной РНК эукариотической праймазой. Однако она не требует для инициации специфических последовательностей в матрице ДНК и обычно начинает синтез напротив пиримидинов, так что на 5’-конце РНК-затравки всегда присутствует пурин. Эукариотическая праймаза в присутствии ДНК-полимеразы a также синтезирует короткие праймерные РНК с «единичной длиной», равной 7-10 н. Вместе с тем, в отсутствие ДНК-полимеразной активности эта праймаза способна элонгировать «единичные» праймеры РНК. Отметим, что бактериальные и эукариотические праймазы являются неточными полимеразами и в среднем включают один ошибочный нуклеотид на 30 н. вновь синтезированной РНК.
|
|
