
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ДНК-лигазы
|
|
ДНК-лигазы катализируют образование фосфодиэфирной связи в однонитевом разрыве (ОР) днДНК между смежными 3’-гидроксильным и 5’-фосфатным концами разорванной нити. Для связывания ДНК-лигаз с ОР в днДНК абсолютно необходима 5’-фосфатная группа, а 3’-ОН-группа не обязательна. Однако обе группы требуются для реакции лигирования. ДНК-лигазы воссоединяют в ДНК только ОР, но не бреши, и пробел длиной даже в 1 н. полностью устраняет связывание фермента с ДНК. ДНК-лигазы участвуют в воссоединении фрагментов Оказаки, образующихся во время синтеза отстающей нити в процессе репликации. Кроме того, ДНК-лигазы устраняют ОР ДНК в процессах репарации и рекомбинации.
Прототипом бактериальных ДНК-лигаз является продукт гена ligA (ранее lig), расположенного на 51-ой мин генетической карты E. coli. Эта ДНК-лигаза имеет длину 671 остаток (мол. м. 73, 7 кД), вызывает воссоединение ОР во всех процессах метаболизма ДНК (репликации, репарации и рекомбинации) и является абсолютно необходимой для роста клеток. В последнее время в полностью секвенированном геноме E. coli была обнаружена открытая рамка считывания, названная ligB и кодирующая вторую, более короткую ДНК-лигазу длиной 562 аминокислотных остатка, гомологичную LigA. Лигаза LigB также катализирует воссоединение ОР в ДНК in vitro, но её физиологическая роль пока не установлена.
У млекопитающих идентифицированы 4 разных типа ДНК-лигаз, содержащихся в ядерных экстрактах клеток. Главной функцией ДНК-лигазы I явлется воссоединение фрагментов Оказаки, хотя она участвует и в репарации ДНК. ДНК-лигаза I человека имеет длину 919 остатков (мол. м. 102 кД) и кодируется геном LIG1, расположенным в хромосоме 19 и содержащим 27 интронов. ДНК-лигазы IIIa, участвующая в эксцизионной репарации ДНК, и IIIb, (известная также как ДНК-лигаза II) кодируются альтернативно сплайсированными мРНК одного и того же гена, и их аминокислотные последовательности различаются только на С-конце. ДНК-лигаза IV по субстратной специфичности отличается от ДНК-лигаз I и III и у мышей является существенным белком. Она участвует в негомоогическом соединении концов ДНК во время репарации двунитевых разрывов ДНК.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
У дрожжей S. cerevisiae отсутствуют гомологи ДНК-лизаз III млекопитающих, а гомолог ДНК-лигазы IV кодируется геном DNL4/LIG4 и также участвует в негомологическом соединении концов ДНК. Главная ДНК-лигаза I у дрожжей кодируется ядерным геном CDC9. Продуктами этого гена являются два белка, которые транслируются в одной рамке считвания, но с использованием разных инициирующих кодонов. При инициации трансляции на первом кодоне АУГ образуется белок длиной 755 остатков, имеющий на N-конце функциональную предпоследовательность, которая нацеливает белок на экспорт в митохондрии. При инициации трансляции на втором кодоне АУГ образуется белок длиной 732 остатка, локализующийся в ядре. После отщепления пропоследовательности в митохондриях первая форма ДНК-лигазы I становится тождественной главной ядерной форме.
Для активности ДНК-лигаз необходимы нуклеотидные кофакторы, в зависимости от природы которых лигазы можно разбить на два класса. ДНК-лигазы эукариотов, археев, бактериофагов, эукариотических вирусов и некоторых эубактерий используют в качестве кофакторов АТФ и относятся к классу I. ДНК-лигазы класса II, кофактором которых служит НАД+, имеются исключительно у эубактерий. ДНК-лигазы LigA и LigB у E.coli принадлежат к этому классу. АТФ-зависимые ДНК-лигазы гетерогенны по размеру (от 30 до > 100 кД), а НАД-зависимые ДНК-лигазы являются высокогомологичными мономерными ферментами с мол. массами 70-80 кД. ДНК-лигазы двух разных классов почти не гомологичны друг другу, за исключением 5 из 6 мотивов последовательности, образующих активный центр суперсемейства нуклеотидилтрансфераз (см. рис. 2.00). Эти мотивы сохраняются и у кэпирующих ферментов эукариотических мРНК, к-рые близки к ДНК-лигазам по механизму действия, но используют в качестве субстрата ГТФ.
Механизм реакции, катализируемой ДНК-лигазами разных классов, состоит из 3 последовательных стадий (рис. 2.20). Первая стадия заключается в активации лигазы – аденилировании с образованием ковалентного интермедиата фермент – АМФ (Е-АМФ), в котором остаток АМФ связан фосфоамидной связью с e-аминогруппой консервативного остатка лизина в консервативном мотиве I активного центра. АТФ-зависимые эукариотические и архейные лигазы используют АТФ при образовании комплекса Е-АМФ и освобождают на первой стадии пирофосфат. Для бактериальных ДНК-лигаз донором АМФ в реакции аденилирования служит НАД+, при расщеплении которого освобождается НМН+. Последующие две стадии одинаковы для лигаз обоих классов.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Во время второй стадии АМФ переносится из комплекса Е-АМФ на 5’-концевую фосфатную группу ОР ДНК с образованием ковалентного интермедиата ДНК-АМФ с (5’®5’)-фосфоангидридной связью. Этот интермедиат является гораздо более короткоживущим, чем комплекс Е-АМФ. На заключительной стадии свободная 3’-гидроксильная группа ОР атакует (5'®5’)-связь в активированном комплексе ДНК-АМФ. Это сопровождается образованием фосфодиэфирной связи, устраняющей ОР в ДНК, и освобождением АМФ.
АТФ-зависимые ДНК лигазы НАД+-зависимые ДНК-лигазы

 Е + рррА Е + НАД+
Е + рррА Е + НАД+
 (-PPi) (-НМН+)
(-PPi) (-НМН+)
ЕрА
(+ 5’-р-ДНК на 5’-конце ОР)
 Арр-ДНК (+ Е)
Арр-ДНК (+ Е)
(+ ДНК-3’-OH на 3’-конце ОР)
ДНК-р-ДНК + рА
лигированная ДНК
O
t



 Общий интермедиат Lys-eN+H2-P--СН2
Общий интермедиат Lys-eN+H2-P--СН2
 EрA O- A
EрA O- A



 О
О

ОН OH
Рис. 2.20. Механизм лигирования ОР ДНК ДНК-лигазами двух классов. Представлена структура общего ковалентного интермедиата ЕрА
Несмотря на различия ДНК-лигаз двух разных классов, они выполняют близкие функции и могут замещать друг друга. Так, условно-летальный мутант E. coli, дефектный по НАД-зависимой лигазе LigA, полностью комплементируется активным фрагментом ДНК-лигазы I человека, а ДНК-лигаза LigA E. coli в свою очередь поддерживает митотический рост мутантов дрожжей с делециями генов CDC9 и LIG4, дефектных по АТФ-зависимым ДНК-лигазам I и/или IV. Однако бактериальная лигаза не исправляет дефект этих мутантов по экспцизионной репарации. Вероятно, для комплементации репаративного дефекта необходимы специфические взаимодействия ДНК-лигазы с родственными репаративными ферментами.
Рассмотрим более детально строение ДНК-лигаз и механизм последней стадии катализируемых ими реакций на примере НАД-зависимой ДНК-лигазы Tfi из термофильной бактерии Thermus filiformis – первой ДНК-лигазы, для которой методом рентгеноструктурного анализа установлена 3-мерная структура. Этот фермент, как и все ДНК-лигазы, имеет модульную организацию и состоит из 4 основных доменов (рис. 2.21). Он имеет длину 667 аминокислотных остатков (мол. м. 75, 9 кД).
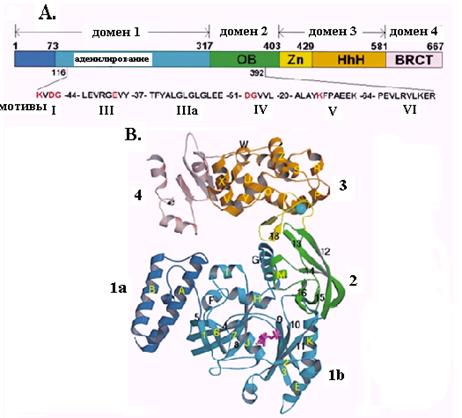
Рис. 2.21. Структура ДНК-лигазы Tfi из T. filiformis.
А. Домены и консервативные мотивы ДНК-лигазы Tfi. 1а – субдомен связывания НАД+, 1b – субдомен аденилирования, 2 – домен связывания олигонуклеотидов с укладкой ОВ, 3 – домен с цинковым пальцем и мотивом HhH спираль-шпилька-спираль, 4 – домен гомологии с белком BRCT; I, III, IV, V и VI – консервативные мотивы суперсемейства нуклеотидилтрансфераз.
B. Трехмерная структура ДНК-лигазы Tfi. Указано положение отдельных доменов
Самым большим является N-концевой домен 1, состоящий из двух субдоменов. На самом конце находится субдомен 1а длиной 73 остатка, являющийся сайтом связывания кофактора НАД+. Субдомен 1b (остатки 73-317) образован 3 антипараллельными b-слоями и несколькими фланговыми a-спиралями и является доменом аденилирования. Субдомен 1b содержит остаток лиз116 активного центра, подвергающийся аденилированию. Следующий домен 2 является доменом связывания олигонуклеотидов, т.к. он имеет укладку связывания олигомеров ОВ, похожую на укладку взаимодействия с онДНК у связывающих он ДНК белков. Домены 1 и 2 содержат все 5 консервативных мотивов нуклеотидилтрансфераз и вместе образуют минимальный домен ДНК-лигазы, достаточный для каталитической активности, т.к. в их пределах расположены все каталитически существенные аминокислотные остатки и остатки, необходимые для специфического связывания ДНК-лигазы с ОР ДНК. Домены 1 и 2 физически взаимодействуют друг с другом, что вызывает значительное повышение аденилирующей активности домена 1. Для такого взаимодействия необходимо сильное изменение конформации белка со смещением С-концевой части домена 2 в сторону домена 1.
Домен 3 (остатки 403-581) является вторым «некаталитическим» контактным участком, обеспечивающим связывание ДНК-лигазы с ДНК. Он образован 2 сегментами белка. Область остатков 403-429 содежит 4 консервативных остатка цистеина, образующих цинковый палец типа Сys4, а смежная область остатков 429-581 включает 4 копии мотива спираль-шпилька-спираль. Обе структуры часто используются белками для взаимодействия с ДНК. На самом С-конце ДНК-лигазы Tfi расположен необычный домен 4, или BRCT, гомологичный C-концевому домену эукариотического белка BRCA1, ассоциированного с раком молочной железы. Он состоит из 4-нитевого параллельного b-слоя и трех a-спиралей и имеется у очень многих лигаз. Домен 4 очень подвижен в так называемой «открытой» конформации ДНК-лигазы и сближен с N-концевым доменом 1а в «закрытой» конформации, в которой лигаза принимает тороидальную форму. Предполагается, что домен 4 играет в лигазе роль ворот, регулирующих связывание и освобождение днДНК. Подобно белку PCNA, в закрытой конформации ДНК-лигаза может образовывать скользящий зажим на ДНК и двигаться по ДНК до тех пор, пока она не встретит ОР. Аналогичную доменную структуру имеет ДНК-лигаза LigA E. coli, а в лигазе LigB отсутствуют два остатка цистеина цинкового пальца и весь С-концевой домен BRCT.
Известная 3-мерная структура ДНК-лигазы Tfi позволила предложить следующую гипотетическую схему (рис. 2.22), которая, вероятно, является общей для многих типов ДНК-лигаз. В исходном состоянии (А) лигаза находится в закрытом неактивном состоянии и неспособна связываться с ДНК. Аденилирование под действием НАД+ или АМФ (стадия I) переводит лигазу в открытое активированное состояние (В), в котором она неспецифически связывается с днДНК, вновь переходит в закрытое состояние С (стадия II) и транслоцируется по днДНК до тех пор, пока не встретит ОР в одной из нитей. Узнавание ОР в ДНК (стадия III) сопровождается изгибанием ДНК и изменением конформации белка на контактной поверхности между доменами 1 и 2. В результате 5’- и 3’-концы ОР оказываются в щели между этими доменами и сближаются с аденилированным остатком лиз116. Это обеспечивает деаденилирование белка и перенос АМФ на 5’-конец разорванной нити (стадия IV). В этом состоянии лигаза связывает катионы Mg2+, необходимые для атаки 3’-гидроксильной группы нити ДНК на активированный АМФ 5’-конец онДНК (стадия V). В результате происходит воссоединение ОР, освобождение неорганического фосфата pi и изменение конформации лигазы с переходом в открытую форму (F). Лигированная ДНК освобождается от ДНК-лигазы, которая возвращается в исходное неактивное закрытое состояние А (стадия VI).
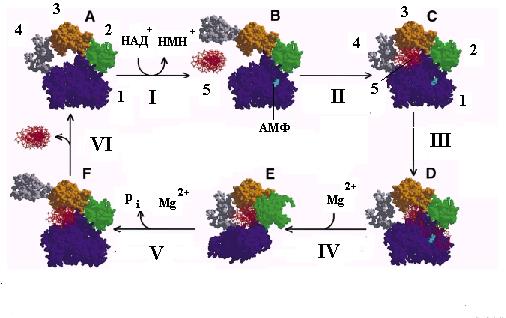
Рис. 2.22. Модель каталитического цикла ДНК-лигазы Tfi.
I – аденилирование, II –связывание с ДНК, III – узнавание ОР и изгибание ДНК, IV – изменение конформации и деаденилирование фермента, V – воссоединение ОР и переход в открытую форму, V – освобождение ДНК.
1-4- домены ДНК-лигазы (см. рис. 2.21), 5 – ДНК с ОР; рi – неорганический фосфат. Стрелками указано положение связанной ДНК и АМФ в аденилированном ферменте
Рассмотрим более детально молекулярный механизм последней стадии лигирования – деаденилирования интермедиата ДНК-АМФ и образования фосфодиэфирной связи между концами ОР (рис. 2.23). В общих чертах, эта реакция протекает с участием 2-валентных катионов металлов так же, как и стадия полимеризации, катализируемой ДНК-полимеразами (см. 1.00). В механизме участвуют два катиона Mg2+, координационно связанные с карбоксильными группами остатков глу281, асп283 и асп118 в домене 1 ДНК-лигазы Tfi. Эти три остатка образуют отрицательно заряженный карман, расположенный рядом с аденилируемым остатком лиз116. Аденилированный интермедиат ДНК-АМФ в лигировании соответствует включаемому в ДНК 5’-дНТФ в реакции синтеза ДНК. В активный центр ДНК-лизазы Tfi входит также положительно заряженный остаток арг196, которые на предыдущей стадии узнавания ОР в ДНК мог электростатически взаимодействовать с отрицательно заряженным 5’-фосфатным концом ДНК. Аналогичную архитектуру активного центра, вероятно, имеют все ДНК-лигазы.
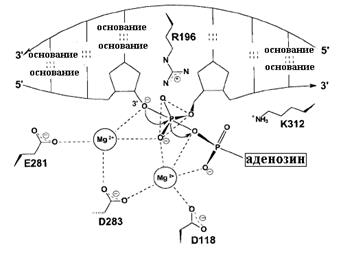
Рис. 2.23. Модель активного центра ДНК-лигазы Tfi на заключительной стадии IV (рис. 2.21) воссоединения ОР.
|
|
