
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Експериментальна частина
|
|
Дослід 1. Взаємодія лужних та лужноземельних металів з водою
У фарфорову чашку налити до половини води і додати 2-3 краплі фенолфталеїну. Пінцетом опустити невеликий шматочок натрію або кальцію. Зазначити інтенсивність реакції. Який газ виділяється під час реакції? Пояснити зміну забарвлення води. Записати рівняння реакції, урівняти методом електронного балансу.
Дослід 2. Дія кислот-неокисників на метали
У три пробірки налити по 2-3 мл розведеної сульфатної або хлоридної кислоти і опустити в них кусочки металів: цинку, заліза, міді. Записати величини стандартних електродних потенціалів і пояснити різницю у властивостях металів. Записати рівняння реакції, урівняти методом електронного балансу.
Дослід 3. Дія кислот-окисників на метали
У три пробірки налити по 2-3 мл розведеної нітратної кислоти і опустити в них кусочки металів: цинку, олова, міді. Які гази виділяються під час реакції? Записати рівняння реакцій, урівняти методом електронного балансу.
Дослід 4. Дія лугів на метали
У три пробірки налити по 2-3 мл розчину лугу (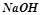 або
або  ) і опустити в них кусочки металів: алюмінію, цинку, заліза. Що спостерігається? Пояснити різницю в поведінці металів. Записати рівняння реакцій, урівняти методом електронного балансу.
) і опустити в них кусочки металів: алюмінію, цинку, заліза. Що спостерігається? Пояснити різницю в поведінці металів. Записати рівняння реакцій, урівняти методом електронного балансу.
Дослід 5. Дія розчинів солей на метали
В одну пробірку налити 2-3 мл розчину купрум (ІІ) сульфату, а в іншу – розчину цинк сульфату. В обидві пробірки опустити кусочки заліза. Записати спостереження та рівняння реакції. Пояснити спостереження на основі значень стандартних потенціалів металів.
ЗАДАЧІ ТА ВПРАВИ
1.Ряд напруг металів. Залежність хімічної активності металів від їх положення в ряду напруг. Які з поданих реакцій відбуваються у водних розчинах:
а) 
б) 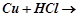
в) 
г) 
д) 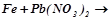
e) 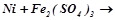
ж) 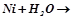
з) 
2.Взаємодія металів з кислотами-окисниками. Закінчити рівняння:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
а) 
б) 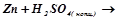
в) 
г) 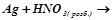
д) 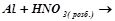
е) 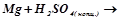
3.Хімічні властивості металів, у яких оксиди та гідроксиди амфотерні. Закінчити рівняння реакції:
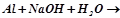
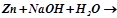
4.Способи одержання металів. Приклади реакцій.
ЛІТЕРАТУРА: [1– c. 285-296; 2 – c. 285-296;
3 – с. 365-457; 4 – с. 252-372].
ЗАНЯТТЯ № 20
Тема: КОРОЗІЯ МЕТАЛІВ
Мета заняття: ознайомитися з механізмом процесів корозії. Дослідити вплив різних чинників на процес корозії металів. Відзначити значні втрати, яких завдає корозія народному господарству, і засвоїти способи боротьби з корозією металів.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Що таке корозія металів? Основні види корозії металів.
2. Механізм електрохімічної корозії. Катодні і анодні процеси при корозії у різних середовищах.
3. Корозія, що виникає внаслідок нерівномірної аерації.
4. Способи захисту металів від корозії.
ТЕОРЕТИЧНІ ВІДОМОСТІ
Металеві матеріали – метали і сплави на основі металів зазнають руйнування, хімічно взаємодіючи з навколишнім середовищем.
Процес самовільного руйнування (окиснення) металів під впливом навколишнього середовища називається корозією. При цьому метал перетворюється у хімічну сполуку: оксид, гідроксид чи сіль:
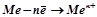 .
.
За механізмом окиснення металів чи сплавів корозія поділяється на хімічну і електрохімічну.
Хімічна корозія відбувається в середовищі агресивного газу або розчину неелектроліту, як правило, при високих температурах.

Електрохімічна корозія – окиснення металу у струмопровідному середовищі.
Умови, необхідні для розвитку електрохімічної корозії – наявність електроліту (струмопровідного середовища) та різниця потенціалів.
Механізм електрохімічної корозії полягає в анодному руйнуванні (окисненні) металу в результаті утворення і роботи гальванічного корозійного короткозамкнутого елемента. У процесі роботи цього елемента метал, який поляризується анодно, окиснюватиметься:
А: Me – nē = Me n+
На катоді відбувається процес відновлення середовища. Залежно від типу середовища він може носити характер водневої або кисневої деполяризації.
У кислому середовищі – воднева деполяризація на катоді.
К:  ;
;
У нейтральному середовищі – киснева деполяризація на катоді.
К: 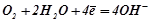 .
.
Іони чи молекули, які відновлюються на катоді, називаються деполяризаторами. При корозії в кислому середовищі деполяризаторами будуть іони Н+, при атмосферній корозії (у вологому повітрі), корозії в грунті, у воді, що містить розчинений кисень, деполяризатором буде кисень.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
Приклад 1. Як відбувається корозія цинку, що знаходиться в контакті з кадмієм:
а) у нейтральному розчині, що містить кисень;
б) у кислому розчині.
Скласти схеми корозійних елементів та рівняння процесів, що відбуваються на електродах. Який склад продуктів корозії?
Розв’язок. Складаємо схеми гальванічних корозійних елементів та записуємо процеси, що відбуваються на катоді і аноді. Цинк має більш негативний потенціал (– 0, 76 В), ніж кадмій (– 0, 4 В), тому він поляризується анодно, а кадмій – катодно.
а) Схема корозійного елемента, коли метали контактують в нейтральному середовищі, що містить кисень (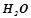 ,
, 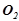 ):
):
ē


(- А) Zn ½ H2O, O2 ½ Cd (K +)
А: 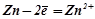 .
.
К: 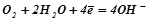 .
.
Додавши ці рівняння почленно, домножуючи перше на 2, одержимо сумарне рівняння процессу корозії:
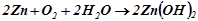
Продуктом корозії буде 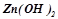 . У нейтральному середовищі гідроксид цинку щільною плівкою захищає поверхнею металу і корозія уповільнюється.
. У нейтральному середовищі гідроксид цинку щільною плівкою захищає поверхнею металу і корозія уповільнюється.
б) Схема корозійного елемента, коли метали контактують в кислому розчині (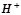 ):
):
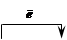
(- А) Zn ½ H+ ½ Cd (K +)
А: 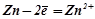 .
.
К: 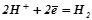 .
.
Сумарне рівняння корозії цинку у кислому середовищі:
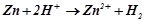 .
.
Продуктом корозії буде сіль цинку 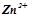 в розчині.
в розчині.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Дослід 1. Утворення окалини на міді та залізі
Нагріти очищені наждачним папером залізну і мідну пластинки в полум’ї пальника протягом 5 хв. Спостерігати зміну забарвлення поверхні пластин внаслідок окиснення. Записати рівняння реакцій. До якого виду корозії відноситься цей процес?
Дослід 2. Корозія на контакті двох різних металів
У пробірку налити розбавлений розчин хлоридної або сульфатної кислот і опустити шматочок цинку. Відмітити інтенсивність виділення водню. Доторкнутися мідною дротинкою до цинку в пробірці. Як змінюється інтенсивність виділення водню і на якому з металів він виділяється?
Пояснити спостереження, врахувавши, що 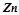 i
i 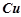 утворюють гальванічну пару. Подати схему гальванічного елемента, записати процеси, що відбуваються на електродах, вказати напрямок переходу електронів у парі
утворюють гальванічну пару. Подати схему гальванічного елемента, записати процеси, що відбуваються на електродах, вказати напрямок переходу електронів у парі  .
.
Дослід 3. Корозія при нерівномірній аерації поверхні металу
В пробірку налити 1 мл розчину  , 0, 5 мл розчину
, 0, 5 мл розчину  i 5-6 крапель фенолфталеїну. На чисту поверхню залізної пластинки нанести паличкою краплю приготовленого реактиву. Спостерігати через деякий час синє забарвлення в центрі краплі (анод) і рожеве на її краях (катод). Написати рівняння реакцій, що відбуваються на анодній і катодній ділянках краплі.
i 5-6 крапель фенолфталеїну. На чисту поверхню залізної пластинки нанести паличкою краплю приготовленого реактиву. Спостерігати через деякий час синє забарвлення в центрі краплі (анод) і рожеве на її краях (катод). Написати рівняння реакцій, що відбуваються на анодній і катодній ділянках краплі.
Дослід 4. Корозія оцинкованого і лудженого заліза
Налити в дві пробірки по 3-4 мл 2н розчину сульфатної кислоти і по три краплі червоної кров’яної солі 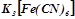 , яка є чутливим реактивом на іони
, яка є чутливим реактивом на іони 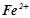 : при наявності іонів
: при наявності іонів 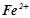 розчин забарвлюється в синій колір. Розчин перемішати скляною паличкою. В одну пробірку опустити смужку оцинкованого заліза, а в другу – залізо, покрите оловом, міддю або нікелем. В якій пробірці утворюється через деякий час синє забарвлення (іони
розчин забарвлюється в синій колір. Розчин перемішати скляною паличкою. В одну пробірку опустити смужку оцинкованого заліза, а в другу – залізо, покрите оловом, міддю або нікелем. В якій пробірці утворюється через деякий час синє забарвлення (іони 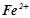 )? Написати рівняння реакцій. Скласти схеми гальванічних корозійних елементів, що виникають при порушенні суцільності покриття. Вказати типи досліджуваних захисних покритть (анодне чи катодне).
)? Написати рівняння реакцій. Скласти схеми гальванічних корозійних елементів, що виникають при порушенні суцільності покриття. Вказати типи досліджуваних захисних покритть (анодне чи катодне).
Дослід 5. Дія іонів, що активують процес корозії
У дві пробірки помістити по смужці алюмінієвої фольги і налити по 1-2 мл розчину 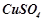 з декількома краплями 2 Н
з декількома краплями 2 Н 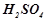 . В одну пробірку внести трохи розчину натрій хлориду. Пояснити збільшення активності процесу у цій пробірці.
. В одну пробірку внести трохи розчину натрій хлориду. Пояснити збільшення активності процесу у цій пробірці.
ЗАДАЧІ ТА ВПРАВИ
1. Скласти рівняння анодного і катодного процесів з водневою і кисневою деполяризацією при корозії на контакті магній–нікель. Які продукти корозії утворюються в першому і другому випадках?
2. Якщо цвях вбити у вологе дерево, то іржею покривається та його частина, яка міститься всередині дерева. Чим це можна пояснити? Анодом чи катодом є ця частина цвяха? Скласти електронні рівняння відповідних процесів.
3. Скласти схеми гальванічних корозійних елементів та рівняння приелектродних процесів з кисневою і водневою деполяризацією при корозії пари алюміній–залізо. Які продукти корозії утворюються в першому і другому випадках?
4. Як відбувається атмосферна корозія заліза, покритого шаром нікелю, якщо суцільність покриття порушено? Скласти рівняння анодного і катодного процесів. Який склад продуктів корозії?
5. Залізний виріб покрили свинцем. Яке це покриття – анодне чи катодне? Чому? Скласти схеми корозійних елементів та рівняння приелектродних процесів корозії цього виробу при порушенні суцільності покриття у вологому повітрі і в розчині хлоридної кислоти. Які продукти утворюються в першому і другому випадках?
6. Написати рівняння процесів, що відбуваються при електрохімічній корозії на контакті цинк – мідь у вологій атмосфері.
7. Навести приклади анодного і катодного покриття заліза для запобігання корозії. Скласти рівняння реакцій, що відбуваютося біля поверхні заліза і біля поверхні захисного шару, якщо цілісність шару порушена.
8. Записати рівняння процесів, що відбуваються при корозії технічного заліза у вологій атмосфері. Врахувати, що технічне залізо містить домішки.
9. Який метал доцільніше вибрати для протекторного захисту від корозії свинцевої оболонки кабеля: цинк, магній чи хром? Чому? Скласти схему корозійного елемента і рівняння анодного і катодного процесів атмосферної корозії. Який склад продуктів корозії?
10. Дві залізні пластинки, частково покриті одна оловом, інша міддю, знаходяться у вологому повітрі. На якій з цих пластинок швидше утворюється іржа? Чому? Скласти схеми корозійних елементів і рівняння анодного і катодного процесів корозії цих пластинок. Який склад продуктів корозії заліза?
11. Який з металів руйнуватиметься в кожній корозійній парі: 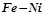 ,
, 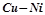 ,
, 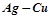 ?
?
12. Записати процеси, що відбуваються при електрохімічній корозії на контакті 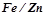 у вологій атмосфері.
у вологій атмосфері.
13. Отвір у залізній посудині запаяно міддю. Як відбувається процес корозії на контакті  , якщо посудина заповнена водою, яка не містить кисню?
, якщо посудина заповнена водою, яка не містить кисню?
14. Смужку лудженого заліза занурили в розчин розбавленої сірчаної кислоти, в який додали трохи трохи розчину червоної коров’яної солі. Як пояснити виникнення через деякий час синього забарвлення розчину? Записати рівняння процесів, що відбуваються.
15. Який з металів руйнуватиметься в кожній корозійній парі: 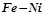 ,
,  ,
,  ?
?
16. Записати процеси, що відбуваються при електрохімічній корозії на контакті 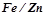 у вологій атмосфері.
у вологій атмосфері.
17. Отвір у залізній посудині запаяно міддю. Як відбувається процес корозії на контакті 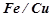 , якщо посудина заповнена водою, яка не містить кисню?
, якщо посудина заповнена водою, яка не містить кисню?
18. Смужку лудженого заліза занурили в розчин розбавленої сірчаної кислоти, до якого додали трохи розчину червоної кров’яної солі. Як пояснити виникнення через деякий час синього забарвлення розчину? Записати рівняння процесів, що відбуваються.
ЛІТЕРАТУРА: [1 – c. 249-262; 2 – c. 374-388;
3 – с. 500-514; 4 – с. 367-372].
ЗАНЯТТЯ № 21
Тема: ХІМІЧНІ ВЛАСТИВОСТІ НЕМЕТАЛІВ
Мета заняття: вивчити хімічні властивості неметалів – взаємодію з водою, кислотами, лугами та солями. Пов’язати хімічну активність неметалів з розташуванням у періодичній системі елементів.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Розташування елементів неметалів у періодичній системі.
2. Загальні фізичні властивості неметалів.
3. Основні хімічні властивості неметалів.
4. Оксигеновмісні сполуки неметалів, їх властивості.
ТЕОРЕТИЧНІ ВІДОМОСТІ
Із 110 відомих на сьогодні хімічних елементів 22 є неметалами. Для неметалів скоріше притаманна відмінність, ніж спільність властивостей. Однак це не означає, що загальної оцінки властивостей їм не можна дати.
У періодичній системі неметали розташовані тільки в головних підгрупах у кінці малих та великих періодів.
Число електронів на зовнішньому енергетичному рівні дорівнює номеру групи. Атоми неметалічних елементів на зовнішньому енергетичному рівні мають, як правило, від 4 до 8 електронів. Під час хімічних реакції атоми неметалів здатні приєднувати електрони і виявляти властивості окисників. Здатність приєднувати електрони підвищується зі збільшенням порядкового номера неметалу в періоді та зменшується з його зростанням в групі. За здатністю приєднувати електрони елементи-неметали можна розташувати в такій послідовності F > O> Cl > N > S > C > P > H > Si. В атомів цих елементів зменшення здатності приєднувати електрони відповідає зменшенню їхніх значень електронегативності. Найвище значення електронегативності виявляє Фтор.
Неметалеві елементи утворюють прості речовини неметали. За звичайних умов неметали – це гази (водень, азот, хлор, кисень тощо), рідини (бром) та тверді речовини (сірка, фосфор, йод). Неметали зазвичай діелектрики (сірка, йод, фосфор) або напівпровідники (кремній), лише графіт є провідником. Вони погано проводять теплоту, крихкі. Багато неметалів нерозчинні у воді, але добре розчиняються в органічних розчинниках. Активні неметалеві елементи зустрічаються у природі лише у зв’язаному вигляді (NaCl, Ca3(PO4)2 тощо). Менш активні неметали існують у природі у вільному стані (С, S тощо). Одержують неметали електролізом розчинів та розплавів, а також окисненням більш активними окисниками.
Типові неметали взаємодіють з металами і утворюють сполуки з йонним зв’язком, наприклад, натрій хлорид NaCl, магній оксид MgO тощо. За певних умов неметали здатні взаємодіяти між собою, утворюючи сполуки з ковалентним типом зв’язку – як полярні, так і не полярні. Прикладом перших є вода H2O, хлороводень HCl, амоніак NH3, прикладом других карбон (II) оксид CO, метан СH4.
З Гідрогеном неметали здатні утворювати леткі сполуки, до прикладу, фтороводень HF, сірководень H2S, аміак NH3, метан СH4. Під час розчинення у воді водневі сполуки галогенів, сульфуру, селену, телуру утворюють кислоти такого самого складу, що і водневі сполуки: HCl, H2S, H2Sе, H2Те.
З Оксигеном неметали утворюють кислотні оксиди. В одних оксидах вони виявляють максимальний ступінь окиснення (SO3, P2O5), в інших – нижчий (SO2, P2O3). Кислотним оксидам відповідають кислоти. Причому, із двох оксигеновмісних кислот сильнішою буде та, у якій ступінь окиснення елемента є вищим. Наприклад, нітратна кислота HNO3 сильніша, ніж нітритна HNO3, а сульфатна H2SO4 сильніша за сульфітну H2SO3.
|
|
