
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ЗАНЯТТЯ № 15
|
|
Тема: ОКИСНО–ВІДНОВНІ РЕАКЦІЇ
Мета заняття: ознайомитись з окисно-відновними процесами, засвоїти поняття «окисник», «відновник», «ступінь окиснення». Навчитись розрізняти процеси окиснення та відновлення. Вивчити вплив середовища на окисно-відновні процеси.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Ступені окиснення елементів.
2. Процеси окиснення та відновлення.
3. Основні окисники та відновники.
4. Типи окисно-відновних реакцій.
5. Вплив середовища на окисно-відновні процеси.
ТЕОРЕТИЧНІ ВІДОМОСТІ
Реакції, які супроводжуються зміною ступеня окиснення елементів, називають окисно-відновними (ОВР).
Ступінь окиснення елемента (ст.ок.) – умовний заряд, який обчислюється, виходячи з припущення, що електронейтральна молекула складається тільки з іонів. Наприклад: 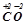 ,
, 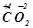 ,
,  ,
, 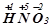 ,
, 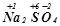 .
.
Зміна ступеня окиснення в хімічних реакціях зумовлюється зміщенням електронів від одного атома до іншого (повне зміщення у випадку утворення іонного зв’язку і часткове – коли зв’язок ковалентний полярний).
Наприклад, при взаємодії електронейтральних атомів натрію і хлору утворюється два заряджених іони: 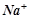 і
і  :
:
 .
.
Втрата електронів – процес окиснення:
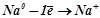
Приєднання електронів – процес відновлення:
 .
.
Атоми, молекули або іони, що віддають електрони (збільшують ст.ок.), називають відновниками ( ). У реакції відновники окиснюються. Атоми, молекули або іони, що приєднують електрони (зменшують ст.ок.), називають окисниками (
). У реакції відновники окиснюються. Атоми, молекули або іони, що приєднують електрони (зменшують ст.ок.), називають окисниками (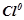 ). Під час реакції вони відновлюються.
). Під час реакції вони відновлюються.
У ОВР процеси окиснення і відновлення взаємопов’язані: число електронів, які віддає відновник, завжди рівне числу електронів, які приєднує окисник.
Ступені окиснення позначають над символом елемента арабською цифрою із знаком «+» чи «–», наприклад: Mn+2, Mn+7, S-2,
N-3, P+5.
Правила визначення ступеня окиснення
1. Ступінь окиснення елементів в простих речовинах дорівнює 0:  ,
, 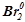 ,
,  ,
,  .
.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
2. В іонних сполуках ступінь окиснення дорівнює заряду іона:  ступінь окиснення –1;
ступінь окиснення –1;  ступінь окиснення +1.
ступінь окиснення +1.
3. Сума ступенів окиснення всіх атомів або іонів, які входять до складу сполуки, рівна нулю, бо молекула електронейтральна. Наприклад: 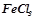 :
:  .
.
4. Cума ступенів окиснення всіх атомів у іоні дорівнює заряду іона. Зарад іона 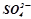 єсумою ступенів окиснення сульфуру:
єсумою ступенів окиснення сульфуру:
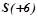 і оксигену
і оксигену 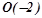 :
: 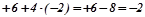 .
.
5. Окремі елементи майже в усіх своїх сполуках проявляють один і той же ступінь окиснення. До таких належать елементи:
K+1, Na+1, Н+1 (за виключенням гідридів металів, де Гідроген має ступінь окиснення -1: NaH-1, KH-1, CaH2-1), Mg+2, Ca +2; F-1; Al+3;
Cl-1 (у сполуках з Гідрогеном і металами); O-2 (за винятком пероксидів H2O-12, Na2O-12).
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Дослід 1. Окиснення натрій сульфіту калій біхроматом
Налити в пробірку 1-2 мл розчину К 2 Cr 2 O 7, підкислити його розбавленою сульфатною кислотою і додати розчин натрій сульфіту. Спостерігати зміну оранжевого забарвлення розчину на зелений внаслідок відновлення іонів Cr 2 O 7-2 до Cr +3. Іон SO 3-2 окислюється при цьому в SO 4-2. Записати рівняння реакції, урівняти його методом електронного балансу.
Дослід 2. Окиснювальні властивості іонів Fe 3+
Налити в пробірку 1-2 мл розчину ферум (ІІІ) хлориду, добавити 1-2 мл розчину калій йодиду і 1 мл розчину крохмалю. Що спостерігається? Записати рівняння реакції, урівняти його методом електронного балансу.
Дослід 3. Взаємодія міді з нітратною кислотою
В пробірку опустити мідну дротину і обережно налити 2-3 мл концентрованої нітратної кислоти. Спостерігати виділення газу. Скласти рівняння реакції і урівняти його методом електронного балансу.
Дослід 4. Залежність окиснювальної здатності 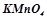 від рН середовища
від рН середовища
У три пробірки налити по 1-2 мл розчину калій перманганату. Створити у пробірках різне середовище, додавши по 1 мл: в першу пробірку – розведеної сульфатної кислоти, в другу – дистильованої води, в третю – розчину натрій гідроксиду. Перемішати розчини скляною паличкою. В кожну пробірку долити розчин натрій сульфіту до зміни забарвлення. Записати спостереження. Методом електронного балансу підібрати коефіцієнти у виконаних реакціях:
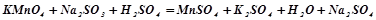 ;
;
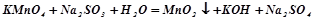 ;
;
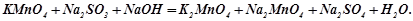 Зробити висновок про залежність сили окисника від реакції середовища.
Зробити висновок про залежність сили окисника від реакції середовища.
ЗАДАЧІ ТА ВПРАВИ
1. Визначити ступінь окиснення елементів у слідкуючих речовинах: 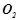 ,
,  ,
, 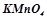 ,
, 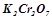 ,
,  ,
, 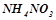 ,
,  .
.
2. Які з наведених нижче схем виражають процес окиснення, а які – відновлення:
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
 ;
; 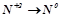 ;
; 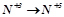 ;
; 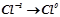 ;
; 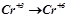 ;
;  ;
;  ;
; 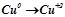 ;
; 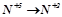 ;
; 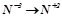 ;
; 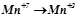 ;
; 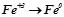 .
.
Визначити число електронів, які втрачаються або приєднуються в кожному процесі.
3. Які властивості – окисні чи відновні – виявляють речовини:
 ,
,  ,
, 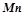 ,
, 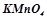 ,
,  ,
, 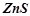 ?
?
ЛІТЕРАТУРА: [1 – с. 234-235, с.273-279; 2 – с. 152-159;
3 – с. 285-310; 4 – с. 129-140].
|
|
