
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ЗАНЯТТЯ № 16
|
|
Тема: УРІВНЮВАННЯ РІВНЯНЬ ОКИСНО–ВІДНОВНИХ РЕАКЦІЙ МЕТОДОМ ЕЛЕКТРОННОГО БАЛАНСУ
Мета заняття: ознайомитись з окисно-відновними процесами, засвоїти поняття «окисник», «відновник», «ступінь окиснення». Навчитись розрізняти процеси окиснення та відновлення. Вивчити вплив середовища на окисно-відновні процеси.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Ступені окиснення елементів.
2. Процеси окиснення та відновлення.
3. Основні окисники та відновники.
4. Типи окисно-відновних реакцій.
5. Вплив середовища на окисно-відновні процеси.
ТЕОРЕТИЧНІ ВІДОМОСТІ
При складанні рівнянь методом електронного балансу дії виконуються у наступній послідовності:
- записується схема реакції – речовини, що реагують, і продукти реакції;
- виставляються ступені окиснення всіх елементів у рівнянні, підкреслюються ті, що змінили ступінь окиснення;
- записуються електронні рівняння, які показують перехід електронів від відновника до окисника;
- складається електронний баланс: число втрачених і приєднаних електронів повинно бути рівним;
- обчислені при складанні балансу окисно-відновні коефіцієнти виставляються у рівняння;
- урівнюють метали, неметали, Гідроген, правильність урівнювання рівняння перевіряють за Оксигеном.
Приклад:
 ,
,
|
 електронні рівняння:
електронні рівняння:

ЗАДАЧІ ТА ВПРАВИ
4. У наведених реакціях вказати окисник, відновник, підібрати коефіцієнти методом електронного балансу:
1.  ;
;
2. 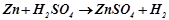 ;
;
3.  ;
;
4.  ;
;
5. 
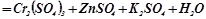 ;
;
6.  ;
;
7.  ;
;
8.  ;
;
9. 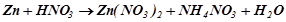 ;
;
10.  ;
;

 ;
;
11.  ;
;
12. 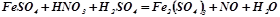 .
.
ЛІТЕРАТУРА: [1 – с. 234-235, с.273-279; 2 – с. 152-159;
3 – с. 285-310; 4 – с. 129-140].
ЗАНЯТТЯ № 17
Тема: ЕЛЕКТРОХІМІЧНІ ПРОЦЕСИ. ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ
Мета заняття: вивчити електрохімічні процеси, що відбуваються при роботі гальванічних елементів. Навчитись складати схеми гальванічних елементів, визначати анод, катод, обчислювати електрорушійну силу.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Електродний потенціал.
2. Ряд напруг металів.
3. Будова гальванічного елемента.
4. Електрорушійна сила гальванічного елемента.
5. Рівняння Нернста.
ТЕОРЕТИЧНІ ВІДОМОСТІ
Якщо металеву пластинку занурити у розчин електроліту, то частина іонів металу під впливом полярних молекул води переходить у розчин, а іони металу з розчину солі переходять на метал:
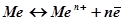 .
.
На межі «метал / розчин електроліту» за рахунок виходу іонів з розчину на металі утворюється подвійний електричний шар. Система метал / розчин електроліту називається електродом, а потенціал, який встановлюється на електроді при зрівноваженні прямого і зворотного процесів, називається рівноважним електродним потенціалом металу ( 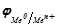 ). Величина рівноважного електродного потенціалу залежить від природи металу, концентрації його іонів у розчині і від температури.
). Величина рівноважного електродного потенціалу залежить від природи металу, концентрації його іонів у розчині і від температури.
Стандартним електродним потенціалом металу  називають рівноважний електродний потенціал, який виникає при зануренні металу в розчин його солі з концентрацією іонів
називають рівноважний електродний потенціал, який виникає при зануренні металу в розчин його солі з концентрацією іонів 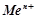
 , виміряний у порівнянні з стандартним водневим електродом при температурі 298К.
, виміряний у порівнянні з стандартним водневим електродом при температурі 298К.
Якщо метали розташувати в ряд за величинами стандартних електродних потенціалів у порядку їх зростання, то одержимо електрохімічний ряд напруг металів (додаток 4). Тому, що значення потенціалу характеризує окисно-відновні властивості системи Men+/Me, місце металу в ряду напруг визначає його хімічну відновну активність у водних розчинах. Більш активним відновником є той метал, потенціал якого менший, тобто той, що розташований ближче до початку ряду напруг.
За умов, що відрізняються від стандартних, величина рівноважного потенціалу металу визначається за рівнянням Нернста, що є спрощеним загальним рівнянням електродного потенціалу:
 ,
,
де 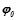 - стандартний електродний потенціал металу, В;
- стандартний електродний потенціал металу, В;
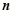 - число втрачених чи приєднаних електронів;
- число втрачених чи приєднаних електронів;
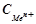 - концентрація іонів металу в розчині солі, моль/л.
- концентрація іонів металу в розчині солі, моль/л.
Якщо скласти електрохімічне коло з двох електродів, сполучити електроди провідником і забезпечити перехід іонів між електролітами, то в одержаній системі буде здійснено напрямлений рух електронів за рахунок різниці потенціалів електродів. Від електрода з меншим значенням потенціалу (анод, від’ємний полюс) електрони переміщаються до електрода з більшим значенням потенціалу (катод, додатній полюс). У системі виникає електричний струм. При цьому на аноді іде процес окиснення, на катоді – відновлення. Такий прилад називається гальванічним елементом. Гальванічний елемент – це пристрій, в якому хімічна енергія самодовільної окисно-відновної реакції перетворюється в електричну.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Електрорушійна сила гальванічного елемента (ЕРС, В) рівна різниці потенціалів катода і анода:
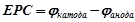 .
.
Мідно-цинковий гальванічний елемент
Електродами є цинкова і мідна пластини у розчинах їх сульфатів.
 Схема гальванічного елемента:
Схема гальванічного елемента:
Процеси на електродах:
A: 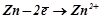 ;
;
K: 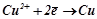 .
.
Струмоутворююча реакція:
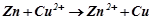 (іонне рівняння);
(іонне рівняння);
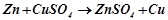 (молекулярне рівняння).
(молекулярне рівняння).
Концентраційний гальванічний елемент
При різних концентраціях електролітів можна одержати різницю потенціалів між електродами, виготовленими з одного металу. На цьому принципі працюють концентраційні гальванічні елементи.
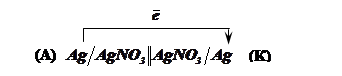 Схема концентраційного гальванічного елемента:
Схема концентраційного гальванічного елемента:
|
A: 
K:  .
.
Струмоутворююча реакція:
 (іонне рівняння);
(іонне рівняння);
 (молекулярне рівняння).
(молекулярне рівняння).
|
|
