
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Експериментальна частина. Дослід 1. Дослідження відновної активності металів
|
|
Дослід 1. Дослідження відновної активності металів
Налити в окремі пробірки по 15-20 крапель розчину солей цинку, нікелю, олова, свинцю, міді. Опустити в кожну з них на 1-2 хв по кусочку заліза. Що спостерігається? Написати рівняння реакцій.
Враховуючи величини стандартних електродних потенціалів (додаток 4), заповнити таблицю, ставлячи знак «плюс» в тих випадках, коли метали витіснялись із солей, або знак «мінус», коли витіснення не відбулось.
| Занурений метал | Іони металу в розчині | ||||
| Zn 2+ : | Ni 2+ : | Sn 2+: | Pb 2+: | Cu 2+: | |
| Магній | |||||
| Цинк | |||||
| Залізо | |||||
| Свинець |
Досліджувані метали розташувати в ряд у порядку зменшення їх відновлювальної здатності, вказавши значення їх стандартних електродних потенціалів (додаток 4).
Дослід 2. Гальванічний елемент Даніеля-Якобі
Налити в одну кювету 1 М розчин  в другий – 1 М розчин
в другий – 1 М розчин  . Опустити в ці розчини відповідно цинкову та мідну пластинки з приєднаними до них провідниками. З’єднати розчини електролітичним містком, заповненим гелем з розчину калій хлориду, а провідники під’єднати до вольтметра. Заміряти ЕРС складеного гальванічного елемента. Замінити в цинковому півелементі 1 М розчин
. Опустити в ці розчини відповідно цинкову та мідну пластинки з приєднаними до них провідниками. З’єднати розчини електролітичним містком, заповненим гелем з розчину калій хлориду, а провідники під’єднати до вольтметра. Заміряти ЕРС складеного гальванічного елемента. Замінити в цинковому півелементі 1 М розчин  на 0, 01 М, попередньо сполоснувши цинкову пластинку дистильованою водою. Добре перемішати розчин
на 0, 01 М, попередньо сполоснувши цинкову пластинку дистильованою водою. Добре перемішати розчин  і після двох хвилин роботи гальванічного елемента заміряти ЕРС.
і після двох хвилин роботи гальванічного елемента заміряти ЕРС.
Повторити вимірювання ЕРС, послідовно замінюючи 1 М розчин  в мідному півелементі на 0, 01 М розчин
в мідному півелементі на 0, 01 М розчин  , а далі 0, 01 М розчин
, а далі 0, 01 М розчин  на 1 М розчин
на 1 М розчин  .
.
Записати схему складеного гальванічного елемента, вказавши, який з електродів є анодом, а який – катодом. Написати електрохімічні рівняння процесів, що відбуваються біля електродів при роботі гальванічного елемента та сумарне рівняння.
Виписати значення стандартних електродних потенціалів міді і цинку (додаток 4), обчислити теоретичні значення ЕРС складених гальванічних елементів і порівняти їх зі значеннями, одержаними експериментально.
Одержані дані записати в таблицю:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
| Молярна концентрація електролітів моль / л | ЕРСексп ., В: | ЕРС теор., В: | Відносна похибка, % | |

| 
| |||
| 1, 00 | 1, 00 | |||
| 0, 01 | 1, 00 | |||
| 0, 01 | 0, 01 | |||
| 1, 00 | 0, 01 |
Зробити висновок, при якому співвідношенні концентрацій анодного і катодного електролітів значення ЕРС максимальне. У якому випадку зміна концентрацій електролітів не приводить до зміни ЕРС?
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
Приклад 1. Дві залізні пластинки опустили в пробірки з розчинами  і
і  . В якій пробірці відбудеться реакція?
. В якій пробірці відбудеться реакція?
Розв’язок. За даними таблиці стандартних електродних потенціалів (додаток 4) потенціал заліза більший за алгебраїчною величиною, ніж потенціал цинку:
j0 (Fe 2+/ Fe) = -0, 44 В;
j0 (Zn 2+ / Zn) = -0, 76 В.
Отже, залізо менш активне, ніж цинк, і не може витіснити його з солі. Реакція заліза з ZnSO4 не відбудеться.
Оскільки значення j0 Fe 2+/ Fe (-0, 44 В) менше, ніж j0Cu2+/Cu (+0, 34 В), то залізо, як більш активний метал витіснить мідь з її солі. Залізо буде реагувати з розчином купрум сульфату:
Fe + CuSO4 = Cu + FeSO4.
Електронні рівняння:
Fe - 2e ® Fe2+ (окиснення, Fe – відновник);
Cu2+ + 2е ® Cu 0 (відновлення, Cu2+ - окисник).
Приклад 2. Магнієву пластинку опустили в розчин солі Mg2+. При цьому рівноважний потенціал магнію виявився рівним –2, 41 В. Обчислити концентрацію іонів Mg2+ (моль/л).
Розв’язок. За рівнянням Нернста:
 ;
;
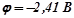 ;
;  ;
; 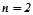 ;
;




Приклад 3. Скласти схему гальванічного елемента, в якому електродами є магнієва і цинкова пластинки, опущені в розчини їх солей з концентрацією іонів по 1 моль/л. Записати рівняння процесів на електродах, рівняння окисно-відновної реакції, що відбувається в цьому гальванічному елементі, і вирахувати його електрорушійну силу.
Розв’язок. Схема гальванічного елемента:
ē
 (- A) Mg ½ Mg2+ ½ ½ Zn 2+ ½ Zn (К+)
(- A) Mg ½ Mg2+ ½ ½ Zn 2+ ½ Zn (К+)
j0 Mg2+/Mg = -2, 37 B; j0 Zn2+/Zn = - 0, 763 B.
Анод – магнієвий електрод, бо його потенціал менший, ніж цинку.
На аноді відбувається процес окиснення:
Mg – 2ē ® Мg2+.
Катод – цинковий електрод, на катоді – процес відновлення:
Zn2+ + 2ē ® Zn0.
Додавши рівняння електродних процесів почленно, одержимо іонне рівняння окисно-відновної реакції, яка забезпечує роботу цього гальванічного елемента:
Mg + Zn2+ = Mg 2+ + Zn.
Потенціали електродів мають стандартні значення, бо концентрації іонів становлять по 1 моль/л. Тому електрорушійна сила елемента рівна різниці стандартних потенціалів його електродів:
ЕРС = j0 (Zn 2+/Zn) - j0(Mg2+/Mg) = -0, 763 - (- 2, 37) = 1, 607 В.
ЗАДАЧІ ТА ВПРАВИ
1. Скласти схеми двох гальванічних елементів, в одному з яких залізо є катодом, а в другому – анодом. Написати рівняння реакцій, які відбуваються на електродах.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
2. Скласти схему гальванічного елемента, на одному з електродів якого нікель окиснюється. Написати рівняння реакцій, які відбуваються на електродах.
3. Скласти схему гальванічного елемента, на одному з електродів якого відбувається відновлення срібла. Написати рівняння реакцій, які відбуваються на електродах.
4. Розрахувати стандартну ЕРС елемента, в якому відбувається реакція за рівнянням:
 .
.
5. Марганцевий електрод у розчині його солі має потенціал -1, 23 В. Обчислити концентрацію іонів Mn 2+ (моль / л).
6. Скласти схему, написати рівняння електродних процесів і сумарну хімічну реакцію гальванічного елемента, складеного з кадмієвого і мідного електродів з концентрацією іонів  . Розрахувати електрорушійну силу цього елемента.
. Розрахувати електрорушійну силу цього елемента.
7. Скласти схему і написати рівняння електродних процесів гальванічного елемента, складеного зі срібної і свинцевої пластин, опущених у розчини їхніх солей з концентрацією  . Розрахувати електрорушійну силу цього елемента. Чи зміниться вона, якщо концентрації іонів зменшити в 10 раз? Підтвердити розрахунком.
. Розрахувати електрорушійну силу цього елемента. Чи зміниться вона, якщо концентрації іонів зменшити в 10 раз? Підтвердити розрахунком.
8. У якого з гальванічних елементів стандартна електрорушійна сила буде більшою:
Fe ê Fe 2+ ê ê Cu 2+ ê Cu, чи Zn ê Zn2+ ê ê Hg2+ ê Hg?
Підтвердити обчисленнями.
ЛІТЕРАТУРА: [1 – c. 235-249; 2 – c. 270-276; 3 – с. 311-324].
|
|
