
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Використовуючи формулу (13.7), знаходимо ізотонічний коефіцієнт
|
|
( =
= 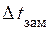 ):
):


За допомогою рівняння (13.6) знаходимо кількість іонів, що утворюються внаслідок дисоціації електроліту:

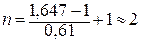 (іони)
(іони)
Таким чином, молекула даного електроліту дисоціює у воді з утворенням двох іонів.
Задача 5. Обчислити ступінь дисоціації та концентрацію іонів Н+ у розчині хлорнуватистої кислоти НClО з концентрацією 0, 01 моль/л. Константа дисоціації кислоти K Д = 5, 8 × 10-8. Як зміниться концентрація іонів Н+, якщо до 1 л вихідного розчину кислоти додати 0, 02 моль NaClО?
Розв’язання. Хлорнуватиста кислота – слабкий електроліт, який у водному розчині дисоціює на іони згідно зі схемою
НClО  Н+ + ClО-.
Н+ + ClО-.
Ступінь дисоціації кислоти a < < 1, тому використовуємо спрощену формулу закону Оствальда:
K Д = a2 С (Х),
де
a = [H+]/ C (Х).
У свою чергу,
[H+] =  ;
;
[H+] =  = 2, 41 × 10-5 (моль/л);
= 2, 41 × 10-5 (моль/л);
a = 2, 41 × 10-5/0, 01 = 2, 44 × 10-3.
Ступінь дисоціації слабкого електроліту сильно зменшується, якщо до розчину додати сильний електроліт з однойменним іоном. У цьому випадку під час дисоціації NaClО (a = 1) утворюються однойменні ClО--іони:
 NaClО Na+ + ClО-.
NaClО Na+ + ClО-.
Тому у розчині збільшується концентрація іонів ClО- і, відповідно, зменшується концентрація іонів Н+. Це обумовлено зміщенням рівноваги (формула (15.13)) вліво – у напрямі процесу моляризації.
Позначимо нову концентрацію іонів Н+ через х (тобто С(Н+) = х), тоді концентрація іонів СlО- дорівнюватиме х + С (СlО-), де С (СlО-) – концентрація іонів СlО-, що утворилися дисоціацією сильного електроліту NaClО:
С (СlО-) = С (NaClО) =  ;
;
С (СlО-) = 0, 02 / 1 = 0, 02 (моль/л).
Константа рівноваги процесу дисоціації кислоти (константа дисоціації) має вигляд
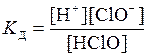 .
.
Через те, що хлорнуватиста кислота дуже слабкий електроліт, можна припустити, що рівноважна концентрація кислоти [HClO] близька до вихідної молярної концентрації: [HClO]» С(HClO).
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Тоді
 ;
;
х 2 + 0, 02 х = 5, 8 × 10-10.
Оскільки величина х 2 достатньо мала, нею можна знехтувати, тоді
0, 02 х» 5, 8 × 10-10
х» 2, 9 × 10-8.
Отже,
С (Н+) = 2, 9 × 10-8 моль/л.
Таким чином, концентрація іонів водню зменшиться приблизно в

Задача 5. Розрахуйте рН та рОН водних розчинів: а) нітратної кислоти з молярною концентрацією 0, 001 моль/л; б) гідроксиду калію з молярною концентрацією 0, 01 моль/л.
Розв’язання:
а) нітратну кислоту вважають сильним електролітом (a = 1), тому схему її дисоціації можна подати у вигляді
HNO3 = H+ + NO3-.
Концентрація іонів H+ та NO3- у розчині сильного електроліту дорівнює молярній концентрації кислоти, тому
[H+] = [NO3-] = C(HNO3) = 0, 001 моль/л.
Тоді
рН = - lg 0, 001 = 3;
рОН = 14 - 3 = 11.
б) гідроксид калію також є сильним електролітом (a = 1), тому схема його дисоціації
KOH = K+ + OH-.
Концентрації іонів K+ та ОН- у розчині цього сильного електроліту дорівнюють його молярній концентрації:
[OH-] = [K+] = C (KOH) = 0, 01 моль/л.
Тоді розраховуємо рОН розчину за формулою (15.9):
pОH = -lg [ОH-];
pОH = -lg 0, 01 = 2;
рН = 14 - 2 = 12.
Задача 6. Розрахуйте рН та рОН водного розчину мурашиної кислоти НСООН з масовою часткою 0, 05 (густина розчину - 1000 г/дм3), якщо константа дисоціації мурашиної кислоти дорівнює 2, 1 · 10-4.
Розв’язання. Мурашину кислоту відносять до слабких електролітів, тобто вона частково дисоціює за схемою
НСООН  Н+ + СОО-.
Н+ + СОО-.
Масову частку розчиненої речовини розраховуємо за формулою (13.8):
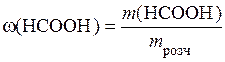 ,
,
тобто маса мурашиної кислоти, що міститься в 1 л розчину:
m (HCOOH) = m розч w(НСООН) = V розч d розч w(НСООН);
m (HCOOH) = 1 × 1000 × 0, 05 = 50 г.
Молярна концентрація розчину кислоти:
С (НСООН) = 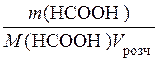 ;
;
М (НСООН) = 46 г/моль;
С (НСООН) =  моль/л.
моль/л.
Оскільки aНСООН < < 1, її константу дисоціації можна визначити за спрощеною формулою закону Оствальда:
K Д =  С (НСООН).
С (НСООН).
У свою чергу,
aНСООН = [H+]/C(HCOOH),
де [H+] - концентрація іонів H+ у розчині мурашиної кислоти, моль/л.
Тоді
[H+] = 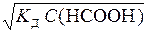 ;
;
[H+] = 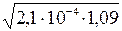 = 1, 51 × 10-2 моль/л.
= 1, 51 × 10-2 моль/л.
Розраховуємо рН розчину за формулою (15.2):
pH = -lg [H+];
pH = -lg(1, 51 × 10-2) = 1, 82.
Оскільки
рН + рОН = 14, то
рОН = 14 - рН = 14 - 1, 82 = 12, 18.
Задача 7. Концентрація насиченого при 20 °С водного розчину H2S дорівнює 0, 1 моль/л. Обчисліть рівноважні концентрації іонів [H+], [HS-], [S2-]. Константи дисоціації кислоти 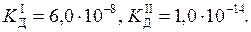
Розв’язання. Сірководнева кислота є слабким електролітом, вона ступенево дисоціює за схемами:
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
H2S  H+ + HS- (
H+ + HS- (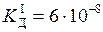 );
);
HS-  H+ + S2- (
H+ + S2- (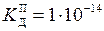 ).
).
Оскільки  , дисоціацією за другим ступенем можна знехтувати.
, дисоціацією за другим ступенем можна знехтувати.
Тоді
[H+]» [HS-] =  ;
;
[H+]» [HS-] =  = 7, 75 × 10-5 моль/л.
= 7, 75 × 10-5 моль/л.
Для приблизного розрахунку [S2-] використовуємо вираз
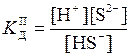 .
.
Враховуючи, що [H+]» [HS-], [S2-]» 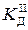 = 1 × 10-14 моль/л.
= 1 × 10-14 моль/л.
Отже,
[H+] = 7, 75 × 10-5 моль/л;
[HS-] = 7, 75 × 10-5 моль/л;
[S2-] = 1 × 10-14 моль/л.
Задача 8. За якої молярної концентрації оцтової кислоти у водному розчині її ступінь дисоціації дорівнює 0, 01? Константа дисоціації оцтової кислоти дорівнює 1, 8 × 10-5.
Розв’язання. Оцтова кислота – слабкий електроліт, що частково дисоціює на іони:
СН3CООН  СН3CОО- + Н+.
СН3CОО- + Н+.
онстанту дисоціації кислоти можна розрахувати за спрощеною формулою закону Оствальда: K Д» a2 С,
С (СН3CООН) = 1, 8 × 10-5/0, 012 = 0, 18 моль/л.
Задача 9. Скільки грамів KOH міститься в 10 л розчину, рН якого дорівнює 11?
Розв’язання. KOH – луг, сильний електроліт (a = 1), який у водному розчині повністю дисоціює на іони:
 KOH K+ + OH-.
KOH K+ + OH-.
Для сильних електролітів концентрація іонів дорівнює молярній концентрації розчиненої речовини, тобто
[OH-] = [K+] = C (KOH).
Оскільки
рОН = 14 - рН, рОН = 14 - 11 = 3, то
[OH-] = 10-рОН,
[OH-] = 10-3 моль/л.
Тоді
C(KOH) = 0, 001 моль/л.
Завдання 10. Напишіть у молекулярній та іонній формі рівняння реакцій і вказати сполуку, утворення якої визначає напрям перебігу процесу:

|
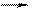
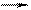 а) Pb(NO3)2 + KI; б) AlBr3 + AgNO3; в) FeCl3 + NH4OH;
а) Pb(NO3)2 + KI; б) AlBr3 + AgNO3; в) FeCl3 + NH4OH;
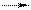 г) NaHCO3 + HNO3.
г) NaHCO3 + HNO3.
Розв’язання:
а) Pb(NO3)2 + 2KI = PbI2¯ + 2KNO3,
|
|
|
Pb2+ + 2I- = PbI2¯.
Оскільки внаслідок взаємодії утворюється поганорозчинний йодид свинцю,
рівновага у системі зміщується у напрямі прямої реакції.
б) AlBr3 + 3AgNO3 = 3AgBr¯ + Al(NO3)3,
|
|
|
Взаємодія у процесі відбувається з утворенням малорозчинного броміду срібла:
Ag+ + Br- = AgBr¯.
|
|
|
|
Fe3+ + 3NH4OH = Fe(OH)3¯ + 3NH4+.
У цьому випадку взаємодія сильного електроліту FeCl3 та слабкого
NH3× H2O º NH4OH приводить до утворення осаду Fe(OH)3, тому рівновага зміщується у напрямі прямого процесу.
|
|
|
|
|
HCO3- + H+ = CO2 + Н2О.
Утворюється газоподібна речовина, тому рівновага у системі зміщується вправо.
Як можна простежити за цими прикладами, зміщення іонних рівноваг іде у напрямі, в якому найповніше відбувається зв’язування іонів, а концентрації вільних, незв’язаних іонів, що залишаються у розчині, стають мінімально можливими.
|
|
