
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гідроліз солей
|
|
Гідроліз єокремим випадком процесу сольволізу – взаємодії розчиненої
речовини та розчинника.
Гідролізом солей називають обмінний процес взаємодії солі з водою, внас-лідок чого утворюються малорозчинні слабодисоційовані речовини або гази.
Можна зауважити, що гідроліз є процесом, оборотним реакції нейтралізації, тобто ендотермічним процесом.
Залежно від природи солі, що підлягає гідролізу, розрізняють декілька його типових випадків:
1. Сіль утворена сильною кислотою і сильною основою, наприклад:
NaCl + HOН  NaOH + HCl;
NaOH + HCl;
Na+ + Cl- + HOН  Na+ + OH- + H+ + Cl-;
Na+ + OH- + H+ + Cl-;
HOН  OH- + H+ (pH = 7 – нейтральне середовище).
OH- + H+ (pH = 7 – нейтральне середовище).
Отже, за звичайних умов гідролізу практично не підлягають солі, утворені сильними кислотами і сильними основами, а також солі, нерозчинні у воді.
2. Сіль утворена слабкою основою і сильною кислотою:
|
 NH4OH + HCl;
NH4OH + HCl;
NH4+ + Cl- + HOН  NH4OH + H+ + Cl-;
NH4OH + H+ + Cl-;
NH4+ + HOН  NH4OH + H+.
NH4OH + H+.
Гідроліз солі відбувається “ за катіоном”. Оскільки при гідролізі солі
утворюється надлишок катіонів Н+, реакція середовища кисла, тобто рН < 7. Отже, реакцію середовища в результаті гідролізу можна визначити за сильнішим електролітом.
Процес гідролізу відбувається таким чином: NH4Cl - сильний електроліт, який у водному розчині повністю дисоційований на іони:
 NH4Cl NH4+ + Cl-.
NH4Cl NH4+ + Cl-.
У свою чергу, йони NH4+ та Cl- у воді гідратовані; тому гідролізу підлягає вже гідратований катіон амонію:
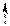





|

 NH4OH + Н+.
NH4OH + Н+.
Якщо сіль утворена багатокислотною основою, гідроліз солі відбувається ступіньчасто, зокрема:
Cu(NO3)2 + HOH  (CuOH)NO3 + HNO3;
(CuOH)NO3 + HNO3;
Cu2+ + 2NO3- + HOH  CuOH+ + NO3- + H+ + NO3-.
CuOH+ + NO3- + H+ + NO3-.
І ступінь: Cu2+ + HOH  CuOH+ + H+, рН < 7 (кисле середовище);
CuOH+ + H+, рН < 7 (кисле середовище);
ІІ ступінь: CuОН+ + HOH  Cu(OH)2 + H+, рН < 7.
Cu(OH)2 + H+, рН < 7.
Як правило, гідроліз солей відбувається тільки за першим ступенем.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
3. Сіль утворена сильною основою та слабкою кислотою:
 СН3СООK СН3СОО- + K+;
СН3СООK СН3СОО- + K+;
СН3СОО- + НОН  СН3СООН + ОН-.
СН3СООН + ОН-.
Гідроліз даної солі відбувається “ за аніоном”. Оскільки внаслідок гідролізу утворюється надлишок ОН-, то реакція середовища лужна (рН > 7).
Якщо сіль утворена багатоосновною кислотою, процес гідролізу солі відбуватиметься ступіньчасто, наприклад:
 Na2CO3 2Na+ + CO32-.
Na2CO3 2Na+ + CO32-.





 І ступінь: CO32- +
І ступінь: CO32- + 
 HCO3- + OH-, рН > 7 (лужне середовище).
HCO3- + OH-, рН > 7 (лужне середовище).
У молекулярному вигляді:
Na2CO3 + HOH  NaHCO3 + NaOH;
NaHCO3 + NaOH;




 ІІ ступінь: НCO3- +
ІІ ступінь: НCO3- + 
 H2CO3 + OH-, рН > 7.
H2CO3 + OH-, рН > 7.
 У молекулярному вигляді:
У молекулярному вигляді:
NaHCO3 + НOH  H2CO3 + NaOH.
H2CO3 + NaOH.
Отже, якщо гідроліз такої солі відбувається тільки за першим ступенем, як продукти гідролізу утворюються кислі солі (NaHCO3 та ін.).
4. Сіль утворена слабкою основою і слабкою кислотою:
 СН3СООNH4 СН3СОО- + NH4+;
СН3СООNH4 СН3СОО- + NH4+;
|
 СН3СООН + NH4OH.
СН3СООН + NH4OH.
Оскільки K д(NH4OH) = 1, 78 × 10-5, а K д(СН3СООН) = 1, 78 × 10-5, то середовище можна вважати нейтральним (рН» 7).
Розглянемо ступіньчастий гідроліз (солі утвореної багатокислотною основою):
- в іонній формі:
І ступінь: Al3+ + 3СН3СОО- + H2O  Al(OH)2+ + 2СН3СОО- + СН3СООН;
Al(OH)2+ + 2СН3СОО- + СН3СООН;
II ступінь: Al(OH)2+ + 2СН3СОО-+ H2O  Al(OH)2+ + СН3СОО- + СН3СООН;
Al(OH)2+ + СН3СОО- + СН3СООН;
III ступінь: Al(OH)2+ + СН3СОО- + H2O  Al(OH)3 + СН3СООН;
Al(OH)3 + СН3СООН;
- у молекулярній формі:
Al(СН3СОО)3 + HOH  (AlOH)(СН3СОО)2 + СН3СООН;
(AlOH)(СН3СОО)2 + СН3СООН;
AlOH(СН3СОО)2 + HOH  Al(OH)2СН3СОО + СН3СООН;
Al(OH)2СН3СОО + СН3СООН;
Al(OH)2СН3СОО + HOH  Al(OH)3 + СН3СООН.
Al(OH)3 + СН3СООН.
У даному випадку реакція середовища залежить від співвідношення констант дисоціації слабких кислоти і основи: вона може бути нейтральною, слабкокислою або слабколужною.
Солі слабкої основи та слабкої кислоти можуть підлягати практично повністю прогідролізувати, якщо як продукт гідролізу утворюється дуже слабка
кислота або дуже слабка основа (або одна з речовин є леткою). Наприклад:
 Al2S3 + 6H2O 2Al(OH)3¯ + 3H2S.
Al2S3 + 6H2O 2Al(OH)3¯ + 3H2S.
Механізм гідролізу солей полягає в поляризаційній взаємодії іонів солі з їхньою гідратною оболонкою. Причому, чим сильніша ця взаємодія, тим інтенсивніше перебігає гідроліз.
Гідроліз є оборотним процесом, тобто його кількісно можна характеризувати константою гідролізу K Г. Розглянемо оборотну реакцію, представлену рівнянням:
KCN + H2O  HCN + KOH.
HCN + KOH.
Запишемо даний процес у іонній формі:
CN- + H2O  HCN + OH-.
HCN + OH-.
Тоді вираз константи рівноваги реакції матиме такий вигляд:
 .
.
У розбавлених розчинах солей рівноважна молярна концентрація води практично не змінюється ([H2O]» const), тому константа гідролізу для випадку солі, утвореної сильною основою і слабкою кислотою, визначається таким чином:
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
K Г = K Р [H2O];
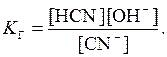
Оскільки йонний добуток води [H+][OH-] = 10-14, [OH-] = 10-14/[H+], то:
 ;
;
 . (15.13)
. (15.13)
Аналогічно вираз константи гідролізу солі, утвореної слабкою основою і сильною кислотою, матиме вигляд
 . (15.14)
. (15.14)
Отже, константа гідролізу солі залежить від іонного добутку води та константи дисоціації кислоти або основи.
Для солі, утвореної слабкою основою і слабкою кислотою, константа гідролізу визначається як:
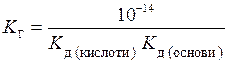 . (15.15)
. (15.15)
Ступенем гідролізу солі bгназивають відношення частки гідролізованої сол
і до загальної кількості солі у розчині в момент досягнення стану рівноваги.
Аналогічно закону розбавлення Ф.В. Оствальда константа гідролізу:
K г» bг2 С (Х),
де С (Х) − молярна концентрація електроліту у розчині, моль/л.
Найчастіше гідроліз є небажаним явищем, тому для його послаблення слід користуватися концентрованими розчинами солей. Оскільки гідроліз є ендотермічним процесом, для його послаблення треба уникати підвищення температури.
Сповільнити процес гідролізу можна, якщо, відповідно до принципу Ле Шательє, підкислювати розчини солей, які мають рН < 7, та додавати луги, якщо рН > 7. У таких випадках можна практично повністю припинити гідроліз солі.
15.7. Запитання для самостійної підготовки
1. Які речовини належать до електролітів, неелектролітів? Сформулюйте основні положення теорії електролітичної дисоціації С.Арреніуса.
2. Що таке електролітична дисоціація? Які речовини здатні до електролітичної дисоціації? Поясніть причини дисоціації речовин на йони у полярних розчинниках.
3. Що характеризують за допомогою ступеня і константи електролітичної дисоціації? Від яких факторів вони залежать?
4. Розгляньте класи неорганічних речовин (кислоти, основи, солі) з погляду теорії електролітичної дисоціації С.Арреніуса.
5. Що називають іонним добутком води? Які фактори впливають на нього?
Для чого потрібен водневий показник рН? Як його можна визначити? Як можна охарактеризувати кислотність середовища?
6. В яких випадках можливі обмінні реакції в розчинах електролітів?
7. Назвіть умови проходження обмінного процесу у розчині?
8. Які типи гідролізу можна виділити? Яким чином можна послабити (посилити) гідроліз?
9. Що називають ступенем гідролізу солі?
|
|
