
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Особливості розчинів електролітів
|
|
У розчинах електролітів експериментально спостерігають деякі відхилення значень осмотичного тиску, змін температур кипіння і замерзання розчинів від закономірностей, встановлених для розчинів неелектролітів.
Для досягнення відповідності між теорією і дослідом Вант-Гофф запропонував
ввести множник і (і > 1), пізніше названий ізотонічним коефіцієнтом. Він показує, у скільки разів збільшується загальна кількість частинок розчиненої речовини внаслідок процесу електролітичної дисоціації, тобто процесу розкладання речовини на іони під впливом полярних молекул розчинника.
Дані про ізотонічні коефіцієнти, які можна виміряти, наприклад, за допомогою тиску насиченої пари, осмотичного тиску або змін температури кипіння і замерзання розчинів електролітів, дозволили С.А.Арреніусу створити теорію електролітичної дисоціації.
Якщо молекула електроліту під час дисоціації розкладається на n іонів, реальна кількість частинок визначається добутком
іС = (1 - a) С + n a С,
де n a С - це кількість іонів; (1 - a) С - кількість молекул, які непродисоціювали. Звідки
і = 1 + a(n - 1), (15.2)
де a - ступінь дисоціації, який дорівнює відношенню кількості молекул
речовини, що розклалися на іони, до загальної кількості розчинених молекул.
Для сильного бінарного електроліту АВ (n = 2), який дисоціює повністю (a = 1) за схемою:
 АВ А Х+ + В Х-,
АВ А Х+ + В Х-,
і = 1 + 1(2 - 1) = 2.
Отже, реальна концентрація іонів у такому розчині буде вдвічі більша від вихідної концентрації молекул розчиненої речовини. Для розчинів електролітів
рівняння осмотичного тиску Вант-Гоффа та законів Рауля мають вигляд
p = іC (Х) RT;
 ;
;
D Т кип = i 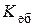 Cm (x);
Cm (x);
D T зам = i 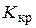 Cm (x). (15.3)
Cm (x). (15.3)
|
|
