
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретическая часть. Катализом называют явление изменения скорости термодинамически возможной химической реакции под влиянием катализаторов – веществ
|
|
Катализом называют явление изменения скорости термодинамически возможной химической реакции под влиянием катализаторов – веществ, участвующих в реакции, но остающихся в неизменном количестве и составе после ее завершения.
Все каталитические процессы подразделяют на две группы: гомогенные и гетерогенные. К гомогенным относятся процессы, в которых реагирующие вещества и катализатор находятся в одной фазе и образуют гомогенную систему. Например, некоторые газофазные каталитические реакции и многие каталитические реакции в растворах. Примером гомогенной каталитической реакции, в которой все участники находятся в одном агрегатном состоянии – газообразном, является окисление оксида серы (IV) кислородом в присутствии оксида азота (IV):
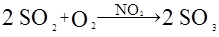
В гетерогенных процессах катализатор представляет самостоятельную фазу, граничащую с фазой реагентов. В этом случае каталитическая реакция протекает на поверхности раздела фаз: газ – твердое тело, жидкость - твердое тело, жидкость – газ. Наибольшее практическое значение имеют каталитические реакции, в которых катализатор находится в твердой фазе, а реагенты – в жидкой или газообразной. Примером гетерогенного каталитического процесса является та же реакция окисления оксида серы (IV) кислородом, но в присутствии твердого оксида ванадия (V):

Можно выделить следующие общие закономерности каталитических реакций. Катализатор не влияет на положение термодинамического равновесия. Он в одинаковой степени изменяет константы скорости прямой и обратной реакций и только ускоряет наступление равновесия. Катализатор не входит ни в состав исходных веществ, ни в продукты реакции, поэтому он не оказывает влияние на изменение энергии Гиббса реакции D r G, являющейся функцией состояния. Следовательно, катализатор не может вызвать протекание реакций, для которых в данных условиях D r G > 0, а может увеличить скорость реакции лишь в том случае, если D r G < 0.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Действие катализатора заключается в том, что он образует с реагирующими веществами промежуточный комплекс, который затем разрушается с образованием продуктов реакции, а сам катализатор освобождается и переходит в исходное состояние. Основной причиной увеличения скорости в результате катализа является значительное уменьшение энергии активации реакции Е А.
Скорость каталитической реакции, как правило, пропорциональна концентрации катализатора (гомогенный катализ) или площади поверхности катализатора (гетерогенный катализ).Например, пероксид водорода в водном растворе медленно разлагается на воду и кислород по уравнению:
Н2О2 = Н2О + 1 / 2 О2 .
Энергия активации этой реакции составляет 75, 6 кДж / моль. В присутствии ионов трехвалентного железа Fe 3 + энергия активации уменьшается до 54, 6 кДж / моль. Наименьшее значение энергии активации соответствует каталитическому разложению в присутствии биологического катализатора - фермента каталазы – 20 кДж / моль. В его присутствии скорость реакции увеличивается приблизительно в 10 8 раз по сравнению с некаталитической реакцией.
Уменьшение энергии активации является не единственной причиной увеличения скорости реакции в присутствии катализатора. В некоторых случаях ускорение процесса обусловлено увеличением предэкспоненциального множителя k 0 в уравнении Аррениуса:
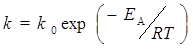 .
.
Катализаторы по своему действию селективны, то есть избирательны. Катализатор увеличивает скорость преимущественно одной из возможных реакций, не влияя заметно на скорость других реакций.
Контрольные вопросы и задачи для предварительной подготовки
|
|
