
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Опыт 2. Зависимость скорости химической реакции от концентрации реагирующих веществ при постоянной температуре
|
|
Налейте в стаканчик 10 мл 0, 5% раствора серной кислоты. В другой стаканчик налейте 10 мл раствора серноватистокислого натрия и 20 мл дистиллированной воды. Затем к раствору кислоты прилейте содержимое второго стакана и отметьте по часам продолжительность опыта. Повторите опыт еще два раза, изменив концентрацию Na2S2O3 ( табл. 2).
Задания:
1. Постройте график зависимости скорости реакции от концентрации серноватистокислого натрия Na2S2O3 (r - C(Na2S2O3));
2. Определите порядок реакции по серноватистокислому натрию (метод Вант-Гоффа)
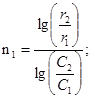
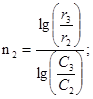
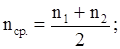
Концентрации растворов Na2S2O3 приведены в табл. 2.
Таблица 2
| № | V(H2SO4), мл | V(Na2S2O3), мл | V(H2O), мл | С (Na2SO3), моль/л | Время реакции, c (n) | Скорость r =100/n |
| 0, 016 | ||||||
| 0, 032 | ||||||
| - | 0, 048 |
Контрольные вопросы для защиты лабораторной работы
1. Каков физико-химический смысл константы скорости реакции? Какие факторы влияют на константу скорости реакции?
2. Какую размерность имеет константа скорости для реакции: а) 1-го порядка; б) 2-го порядка; в) 3-го порядка.
3. Запишите кинетические уравнения для реакций, рассматривая их как элементарные:
а) NO2 + NO2 = N2O4
б) N2O5 = N2O4 + 1/2 O2
в) 2NO + O2 = 2NO2
4. При начальных концентрациях реагентов [A] 01 =2, 3× 10 - 3 моль/л и [B] 01 = 1, 1× 10 - 3 моль/л начальная скорость элементарной газофазной реакции A+B = 2C равна W01 = 2, 5× 10 - 3 моль/(л× с). Какова будет начальная скорость этой реакции W02 при других начальных концентрациях [A] 02 = 1, 9× 10 - 3 и [B] 02 = 10 - 2 моль/л? Считать, что продукты реакции не влияют на скорость прямой реакции.
5. Вычислите, при какой температуре реакция закончится за 5 мин., если при 20°С на это требуется 24 мин. Температурный коэффициент скорости реакции равен 3.
6. Выведите формулу, связывающую температурный коэффициент скорости реакции g и энергию активации реакции EA.
7. Во сколько раз возрастет скорость реакции при повышении температуры от 30°С до 50°С, если энергия активации реакции равна 125 кДж/моль?
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
8. Константа скорости реакции при 600 К равна 7, 5, а при 650 К - 450. Вычислите энергию активации и константу скорости при 700 К.
9. Напишите кинетическое уравнение химической реакции A + 2 B = C, рассматривая ее как элементарную. Определите, во сколько раз возрастет скорость реакции, если:
а) концентрация A увеличится в 2 раза;
б) концентрация B увеличится в 3 раза;
в) концентрация A и B увеличится в 2 раза.
10. Напишите кинетическое уравнение химической реакции
A + B + C ® D + F,
если известно, что при увеличении начальной концентрации вещества A в 2 раза начальная скорость реакции увеличивается в 4 раза, а при увеличении начальной концентрации вещества B в 2 раза начальная скорость реакции увеличивается в 2, 83 раза, а при увеличении начальной концентрации вещества C скорость реакции не изменяется.
|
|
