
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретическая часть. Гетерогенными называются химические реакции, протекающие награнице раздела фаз
|
|
Гетерогенными называются химические реакции, протекающие награнице раздела фаз. К числу таких реакций относятся: горение твердого и жидкого топлива, окисление металлов, восстановление металлов из оксидов и сульфидов; реакции, идущие на поверхности твердых катализаторов. Наиболее частым является случай, когда твердое тело окружено газом или жидкостью:
а) реакция соединение оксида кальция с диоксидом углерода
CaO(к) + CO2(г) = CaCO3(к);
б) термическое разложение карбоната кальция
CaCO3(к) = CaO(к) + CO2(г);
в) реакция металлического цинка с соляной кислотой
Zn (к)+ 2 HCl(р-р) = ZnCl2(р-р) + H2(г);
г) взаимодействие кристаллического нитрата свинца с кристаллическим йодидом калия
Pb(NO3)2(к) + 2 K I(к) = Pb I2(к) + 2 KNO3(к)
Скорость гетерогенной химической реакции определяется изменением поверхностной концентрации одного из веществ (газа или жидкости), участвующих в реакции, за единицу времени:
r = ± d CS / d t, (1)
где CS - поверхностная концентрация вещества - количество молей вещества, приходящееся на единицу реакционной поверхности (моль/м 2 или моль/см 2). Размерность скорости гетерогенной реакции моль/(м 2 Ч с) или моль/(см 2 Ч с). В кинетическое уравнение гетерогенных реакций не входят концентрации веществ в твердом состоянии, если они реагируют лишь с поверхности и, следовательно, их концентрация сохраняется постоянной. Например, в реакции
CaO(к) + CO2(г) = CaCO3(к)
соударения могут происходить только на поверхности раздела фаз. В этом случае в выражение скорости реакции будет входить только поверхностная концентрация [CO2]S
r = k [CO2 ] S (2а)
Определять поверхностную концентрацию вещества довольно трудно. На практике часто скорость гетерогенной реакции вычисляют, используя вместо поверхностной концентрации объемную концентрацию. Например,
r ¢ = k [CO2], (2б)
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
где r ¢ - скорость реакции, k - константа скорости, [CO2] - объемная концентрация CO2 в газовой фазе.
Измерение скорости гетерогенных реакций в моль/(л Ч с) приводит к тому, что r ¢ становится функцией площади реакционной поверхности S, так как чем больше эта площадь, тем больше и число столкновений молекул реагирующих веществ, находящихся в разных фазах гетерогенной системы. Отметим, что при постоянной температуре на единице поверхности раздела фаз число столкновений молекул постоянно. Применительно к гетерогенным реакциям скорость гетерогенной реакции (1) не зависит от площади поверхности раздела фаз, так же как скорость гомогенной реакции не зависит от объема системы. Важное значение при рассмотрении кинетики и механизма гетерогенных реакций имеет адсорбция.
Адсорбцией называется концентрирование вещества в поверхностном слое в результате самопроизвольного перехода его из объема фазы.
Более подробно с этим вопросом вы можете ознакомиться в рекомендуемых учебниках.
В гетерогенных реакциях можно выделить, по меньшей мере, три стадии: 1 - перенос реагирующих веществ к поверхности раздела фаз, в реакционную зону; 2 - химическое взаимодействие; 3 - удаление продуктов реакции из реакционной зоны.
Скорость всего процесса определяется наиболее медленной стадией (она называется лимитирующей), если скорости стадий существенно различаются. Если скорость собственно химического взаимодействия значительно больше скоростей подвода реагентов к реакционной зоне и отвода продуктов, то общая скорость процесса будет определяться скоростями переноса реагентов и продуктов реакции в реакционную зону и удаления из нее. В таком случае общая скорость самопроизвольной термически инициируемой реакции будет определяться диффузией. В этом случае реакция протекает в диффузионном режиме или ее кинетика находится в диффузионной области. Когда собственно химическое взаимодействие является наиболее медленной стадией, а подвод реагентов и отвод продуктов реакции протекают сравнительно быстро, то реакция протекает в кинетическом режиме или ее режим находится в кинетической области. Если скорости реакции и диффузии приблизительно равны, то говорят о переходном режиме или диффузионно-кинетической (переходной) области гетерогенной реакции.
Для гетерогенной реакции типичная форма зависимости логарифма константы скорости ln k от (1 / T) (координаты уравнения Аррениуса) приведена на рис. 1. Участок АВ, на котором k мало или практически не зависит от температуры, соответствует диффузионной области протекания процесса. В этом случае скорость процесса определяется законами диффузии и описывается диффузионными уравнениями. Участок ВС соответствует переходной области протекания процесса. В этом случае скорость процесса определяется и законами диффузии, и законами химической кинетики. Участок CD соответствует кинетической области. Для него обычно характерны значительные величины энергий активации и для его описания пользуются законами формальной кинетики.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
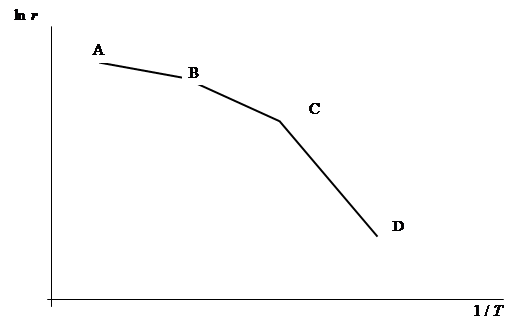 |
Рис. 1. Зависимость логарифма константы скорости реакции от 1/ Т.
Вопросы для предварительной подготовки лабораторной работы
1. Приведите пример гетерогенной реакции из вашего жизненного опыта.
2. Перечислите основные стадии гетерогенной химической реакции.
3. Какой режим протекания гетерогенной химической реакции называется диффузионным, какой - кинетическим, какой - переходным?
4. Напишите кинетические уравнения гетерогенных реакций, считая их элементарными:
2 Mg(к) + O2(г) = 2 MgO(к)
CO2(г) + C(гр) = 2 CO(г)
5. Запишите кинетическое уравнение для реакции:
Mg + 2 HCl(р-р) = MgCl2(р-р) + H2(г) ,
если известно, что это реакция второго порядка.
6. Что понимается под скоростью твердофазной реакции?
7. Какая стадия реакции называется лимитирующей?
8.. В чем особенность применения постулата химической кинетики к гетерогенным реакциям?
|
|
