
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Теоретическая часть. Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами
|
|
Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. К ним относятся кислоты, основания и подавляющее большинство солей. При попадании этих веществ в полярный растворитель происходит электролитическая диссоциация, вызываемая взаимодействием полярных молекул растворителя с частицами растворяемого вещества. Результатом является образование сольватированных заряженных частиц - положительно заряженных катионов и отрицательно заряженных анионов. Электролитическая диссоциация
HCl (газ) + (n + m)H2O D H+× n H2O + Cl-× m H2O,
NaCl (крист) + (p + q)H2O D Na+× p H2O + Cl-× q H2O.
Количественной характеристикой электролитической диссоциации служит степень диссоциации a, равная отношению числа диссоциированных молекул N дисс к исходному числу молекул электролита в растворе N исх:
a = 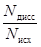 .
.
По способности к электролитической диссоциации электролиты условно подразделяют на сильные и слабые. Сильные электролиты -вещества, в растворе практически полностью диссоциированные на ионы при (a» 1). Слабые электролиты -вещества, степень диссоциации которых a < < 1. В водных растворах сильными электролитами являются такие кислоты, как HClO4, HMnO4, H2SO4, HNO3, HCl, HBr, HI, а также гидроксиды щелочных и щелочно-земельных металлов LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2; большинство солей
Для процесса электролитической диссоциации
К m А n D m 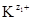 + n
+ n 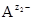 ,
,
где К m А n – молекула электролита, 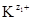 – катион,
– катион, 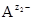 – анион, z – зарядовое число ионов; различают аналитическую, или концентрационную, константу диссоциации К д, с , вычисленную по равновесным концентрациям молекул и ионов:
– анион, z – зарядовое число ионов; различают аналитическую, или концентрационную, константу диссоциации К д, с , вычисленную по равновесным концентрациям молекул и ионов:
Кд, с = 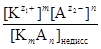 , (1)
, (1)
где [ 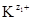 ], [
], [ 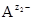 ] - равновесные молярные концентрации катионов и анионов, соответственно; [К m А n ]недисс - равновесная молярная концентрация недиссоциированных молекул электролита. Термодинамическая константа диссоциации Kд, а, вычисляется по равновесным активностям a соответствующих частиц:
] - равновесные молярные концентрации катионов и анионов, соответственно; [К m А n ]недисс - равновесная молярная концентрация недиссоциированных молекул электролита. Термодинамическая константа диссоциации Kд, а, вычисляется по равновесным активностям a соответствующих частиц:
Kд, а = 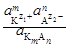 (2)
(2)
Согласно уравнению изобары химической реакции:
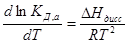
Активность, равна произведению концентрации С на коэффициент активности g
а = С× g
Понятие активности было предложено Льюисом, чтобы можно было использовать для реальных систем термодинамические уравнения, выведенные для идеальных растворов, в которых отсутствуют взаимодействия между компонентами.
Выражение (1) обычно используется для растворов слабых электролитов, поскольку в разбавленных растворах коэффициент активности слабого электролита g»1 и значение активности практически соответствует величине концентрации С частиц. Для растворов сильных электролитов концентрационная константа диссоциации не имеет физического смысла, т.к. концентрация недиссоциированных молекул практически равна нулю. Однако коэффициент активности сильного электролита, отражающий влияние межионных и ион-молекулярных взаимодействий на свойства раствора, g < 1, поэтому для сильных электролитов справедливо выражение (2). Константу равновесия процесса диссоциации принято обозначать К а в случае слабых кислот (от английского слова " acid") и К b для слабых оснований (от слова " base").
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Например, процесс диссоциации щавелевой кислоты протекает следующим образом:
I ступень: H2C2O4 D H+ + HC2O4-, K a(I) = 6, 46× 10–2;
II ступень: HC2O4- D H+ + C2O42-, K a(II) = 6, 17× 10–5;
общее уравнение диссоциации: H2C2O4 D 2H+ + C2O42-, K a = K a(I) × K a(II).
Аналогично для гидроксида свинца можно записать:
I ступень: Pb(OH)2 D PbOH+ + OH-, K b(I) = 9, 55× 10–4;
II ступень: PbOH+ D Pb2+ + OH-, K b(II) = 3, 0× 10–8;
общее уравнение ионизации: Pb(OH)2 D Pb2+ + 2OH-, K b = K b(I) × K b(II).
В случае разбавленных растворов сильных электролитов можно считать, что их диссоциация происходит практически полностью.
|
|
