
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Ионов железа (III)
|
|
В данном опыте в качестве примера гомогенного катализа рассматривается реакция восстановления ионов Fe 3 + ионами S2O3 2 -
2 Fe (NCS)3 + 2 Na2S2O3 = Na2S4O6 + 2 Fe (NCS)2 + 2 NaNCS,
которая ускоряется в присутствии ионов Cu 2 +.
Водные растворы роданида железа (III) имеют кроваво-красную окраску. Реакция его образования используется в аналитической химии для обнаружения ионов Fe 3 +. По времени исчезновения окраски судят о скорости протекания реакции.
1. Приготовьте раствор роданида железа (III) Fe (NCS) 3, смешав в колбочке 5 мл
0, 1 М раствора хлорида железа (III) FeCl 3 и 1 мл 0, 1 М раствора роданида аммония
NH 4 NCS.
2. Пипеткой отберите 1 мл приготовленного раствора в другую коническую пробирку.
3. В третью коническую пробирку налейте 1 мл 0, 1 М раствора тиосульфата натрия Na2S2O3.
4. Содержимое обеих пробирок объедините, для чего раствор Na2S2O3 быстро перелейте в пробирку с раствором Fe (NCS) 3, включив при этом секундомер. Наблюдайте за происходящими изменениями.
5. Отметьте по секундомеру время до полного обесцвечивания раствора, которое условно можно считать временем протекания реакции.
6. Проведите аналогичный эксперимент (операции по пп. 2-5), добавив в пробирку с раствором Fe (NCS) 3 одну каплю 0, 05 М раствора CuSO4.
7. Повторите опыт с тремя каплями 0, 05 М раствора CuSO4.
Обработка результатов
1. Результаты измерений, расчетов и выводы занесите в табл. 2.
2. Приведите уравнения, описывающие появление и исчезновение кроваво-красной окраски у растворов.
3. Рассчитайте условную скорость реакции по формуле:
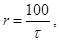
где t - время протекания реакции.
4. На основании полученных результатов сделайте выводы относительно:
а) влияния на скорость реакции восстановления Fe 3 + присутствия ионов Cu 2 +;
б) влияния на скорость этой реакции концентрации ионов Cu 2 +?
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Таблица 2
| Число капель катализатора | Время протекания реакции t, с | Условная скорость r i = 100 / t i | Наблюдения и выводы |
Опыт 3. Гетерогенная каталитическая реакция разложения пероксида водорода
Изучается влияние гетерогенного катализатора (MnO2 или PbO2) на скорость разложения пероксида водорода. Предполагается, что реакция с участием диоксида марганца протекает через следующие стадии:
MnO2 + H2O2 + 2 H + = Mn 2 + + 2 H2O + O2,
Mn 2 + + 2 H2O = Mn(OH)2 + 2 H +,
Mn(OH) 2 + H2O2 = MnO2 + 2 H2O.
Проведение опыта
1. В две пробирки с помощью мерного цилиндра налейте по 3 мл 3 % - го раствора пероксида водорода.
2. В первую пробирку добавьте немного (на кончике шпателя) порошка диоксида марганца MnO 2 (или PbO 2) и одновременно включите секундомер. Отметьте время протекания реакции до окончания выделения пузырьков газа.
3. Проведите аналогичный эксперимент (операции пп. 1-2), добавив в 2 раза больше количествами диоксида марганца (или диоксида свинца).
Обработка результатов
1. Результаты измерений, расчетов и выводы занесите в табл. 3.
Таблица 3
| Катализатор | Условное количество катализатора | Время протекания реакции t, с | Условная скорость реакции r i = 100 / t i | Наблюдения и выводы |
2. Вычислите условную скорость реакции по формуле:
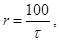
где t - время протекания реакции.
3. Сравните каталитическую активность диоксида марганца и диоксида свинца. За меру активности принимается скорость реакции с данным катализатором при одинаковом их количестве.
4. Сделайте вывод о влиянии количества катализатора на скорость разложения пероксида водорода.
|
|
