
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Зависимость скорости реакции от температуры
|
|
Основное влияние температура оказывает на константу скорости. Из опытных данных Вант-Гофф установил, что при повышении температуры на 10° скорость реакции увеличивается в 2 - 4 раза (правило Вант-Гоффа). Коэффициент g, равный
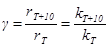 (9)
(9)
был назван температурным коэффициентом скорости реакции.
Правило Вант-Гоффа является приближенным и было установлено для реакций в растворах, протекающих при сравнительно низких температурах. Оно хорошо выполняется для таких реакций, которые идут с удобной для измерения скоростью, то есть не слишком быстро и не слишком медленно. Если известна скорость реакции при температуре T 1 и известен температурный коэффициент, то скорость реакции при температуре T 2 можно определить по уравнению:
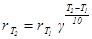 . (10)
. (10)
Более точную зависимость константы скорости реакции от температуры передает уравнение Аррениуса:
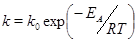 (11)
(11)
в котором EА - так называемая энергия активации, T - абсолютная температура, R - универсальная газовая постоянная (R = 8, 314 Дж/(моль× K), k 0 - предэкспоненциальный множитель, мало зависящий от температуры.
Уравнение Аррениуса часто представляют в полулогарифмической форме:
ln k = ln k 0 - E А/R T, (12)
удобной для графического определения энергии активации. Энергию активации можно определить измерением константы скорости при нескольких разных температурах. Затем строят зависимость ln k от 1/ T. Тангенс угла наклона полученной прямой линии равен (- E А /R).
Энергию активации можно также оценить, если известны константы скорости при двух температурах T 1 и T 2. Тогда для каждой температуры можем записать:
ln k 1 = ln k 0 - EA / RT 1,
ln k 2 = ln k 0 - EA / RT 2.
Вычитая из второго уравнения первое, получаем
ln k 2 - ln k 1= (ln k 0 - EA / RT) - (ln k 0 - EA / RT).
После упрощения получаем:
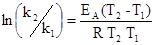
Из этого выражения получаем уравнение для определения энергии активации. Энергия активации измеряется в Дж/моль или к Дж / моль.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
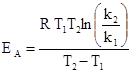 .
.
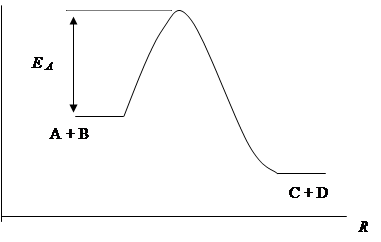
Энергия активации представляет собой величину энергии при данной температуре, которую надо добавить в систему (в расчете на 1 моль) для того, чтобы реагирующие частицы могли вступить в химическую реакцию. Величина ее определяется свойствами реагирующих частиц и их энергетическим состоянием.
В ходе элементарной химической реакции достигается некоторое промежуточное состояние, когда одни связи еще окончательно не разорваны, а новые связи только начали образовываться. Это промежуточное состояние называется активированным комплексом (или переходным состоянием). На разрыв связей требуется затрата энергии, поэтому энергия системы в начале реакции увеличивается.
Изменение энергии системы при протекании элементарной химической реакции изображено на рисунке. Энергия активации EA элементарной химической реакции A + B ® C + D представляет собой высоту барьера потенциальной энергии. Координата реакции r в простейшем случае представляет собой длину разрываемой связи.
| ||||
 | ||||
|
Вопросы для предварительной подготовки лабораторной работы
1. Какова единица измерения скорости химической реакции, какова её размерность?
2. Что такое молекулярность реакции и чем она отличается от её порядка?
3. Что такое активационный барьер реакции, чем измеряется его «высота»?
4. Как влияет на скорость реакции охлаждение реакционного сосуда, т.е. химического реактора?
5. Могут ли реакции не иметь энергии активации и что это может означать?
6. До какого состояния идут обычно обратимые реакции?
7. Какие факторы определяют величину константы скорости?
|
|
