
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Итого 20 баллов. 1. Молярная масса этого соединения равна 61,7 г/моль, если оно содержит одну этильную группу и 123,4 г/моль
|
|
Задача 11-4 (автор Будынина Е. М.)
1. Молярная масса этого соединения равна 61, 7 г/моль, если оно содержит одну этильную группу и 123, 4 г/моль, если таких групп две. Первый ответ невозможен, т. к. молярная масса цинка больше, чем 61, 7. Второй ответ соответствует молекуле диэтилцинка, Et2Zn.
2. Содержание углерода и водорода в Х вместе составляет 81, 8 %. Это заставляет предположить, что цинк в молекуле Х отсутствует, а оставшиеся 18, 2 % приходятся на кислород. Тогда молекулярная формула Х: С5Н12О. Это соединение образуется из этилового эфира муравьиной кислоты (HCO2C2H5) и диэтилцинка, генерируемого in situ из цинка и этилиодида. Пять атомов углерода в Х могут оказаться двумя путями: а) 3 атома углерода из этилформиата и 2 атома из диэтилцинка; б) 1 атом из этилформиата и 4 атома из диэтилцинка. В первом случае молекула Х должна содержать также два атома кислорода, что не соответствует рассчитанной молекулярной формуле. Второй вариант реализуется, если несущий частичный отрицательный заряд атом углерода из диэтилцинка атакует по несущему частичный положительный заряд карбонильному атому углерода, образовавшийся интермедиат отщепляет алкоголят цинка с образованием пропионового альдегида, который реагирует далее со второй молекулой диэтилцинка.
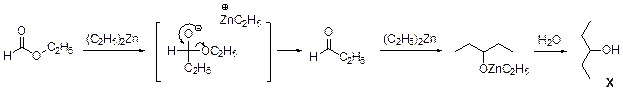
3. Из данных по содержанию в Y разных элементов можно определить молекулярную формулу Y как С9Н16O3. Учитывая ответ на предыдущий вопрос, можно сделать вывод, что диэтилцинк реагирует только по одной сложноэфирной группе:
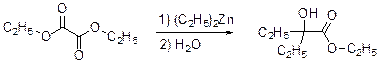
4. Молекулярный пик галогеналкана А проявляется в виде дублета в соотношении 1: 1. Это говорит о том, что один из атомов, присутствующих в молекуле, имеет два изотопа, причем их содержание в природе равно примерно 1: 1. Из четырех галогенов, углерода и водорода такое распределение имеет только бром. Молекулярная формула А: С n H2 n +1Br. Тогда 12 n / (14 n + 81) = 0, 22. Отсюда n = 2. Вещество А – этилбромид. При его реакции с магнием теоретически может образоваться два продукта: диэтилмагний (аналогично реакции с цинком) или этилмагнийбромид. Как известно, реактивы Гриньяра – это алкилмагнийгалогениды. Это можно определить и из данных по содержанию в В водорода: значение, данное в условии, согласуется с формулой C2H5MgBr, но не с формулой (C2H5)2Mg. Когда реактив Гриньяра вылили на сухой лед, прошла реакция C2H5MgBr с СО2 с образованием C2H5СО2– MgBr+, а после нейтрализации выделили соответствующую кислоту С. Если сухой лед добавлять к избытку C2H5MgBr, образующаяся соль реагирует далее. После гидролиза выделяется диэтилкетон (D). Реакция этилбромида с водной щелочью дает этанол (F), который при нагревании с пропионовой кислотой в присутствии H2SO4 превращается в этилпропионат G.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
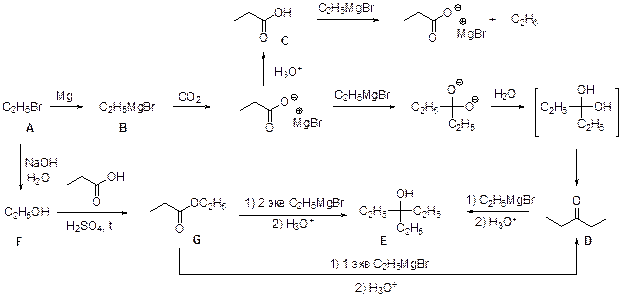
Система оценивания:
1. 2 балла.
2. 2 балла
3. 2 балла
4. 7 структур по 2 балла. Всего 14 баллов.
Итого 20 баллов.
Задача 11-5 (авторы Белый Т. С., Бачева А. В.)
Вопрос 1а. Можно отметить несколько основных факторов, которые реализуются при связывании субстрата ферментом и образования так называемого фермент-субстратного комплекса: это факторы сближения реакционных групп, их фиксации и ориентации. Эти факторы в конечном итоге изменяют путь реакции, так как реакция идет через другие переходные состояния, и понижают энергию активации.
Вопрос 1б. Уравнение протекающей реакции: H2O2 ® H2O + 1/2O2,
отношение скоростей можно рассчитать из отношения констант скоростей:
k (с платиной) / k (без катализатора) =
exp(–12·4, 184·103/ RT) / exp(–18·4, 184·103/ RT) = 2, 36·104.
Поскольку энергия активации находится в показателе степени, следовательно, изменение энергии активации всего на 6 ккал/моль приводит к изменению скорости реакции разложения перекиси более чем на 4 порядка при катализе мелкодисперсной платиной, и еще на
k (с ферментом) / k (с платиной) =
exp(–5, 6·4, 184·103/ RT) / exp(–12·4, 184·103/ RT) = 4, 62·104,
т. е. более чем на 4 порядка при действии фермента.
Вопрос 2
Частичный гидролиз будет приводить к разрыву какой-нибудь одной связи в исходном пептиде после аргинина или лизина, таким образом, получатся следующие пептиды:
Ala-Leu-Gly-Lys-Ala-Arg-Gly-Gly-Lys
Arg-Ala-Leu-Gly-Lys
Ala-Arg-Gly-Gly-Lys
Arg-Ala-Leu-Gly-Lys-Ala-Arg
Gly-Gly-Lys
и аминокислота аргинин.
Гидролиз может быть неполным, если его остановить, убрав ферментативную активность. Для этого, например, можно 1) добавить вещество, инактивирующее фермент, или 2) разрушить сам фермент, а) изменив рН добавлением кислоты, либо б) нагреванием.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Вопрос 3.
Нет, трипсин не будет гидролизовать связи после модифицированного лизина, поскольку в узнавании субстрата ферментом важны именно боковые группы аминокислот, в том числе их размер и заряд. А при модификации изменяется и то, и другое.
Вопрос 4.
а) реакция лизина с динитрофторбензолом будет протекать как по α -, так и по ε -аминогруппе:
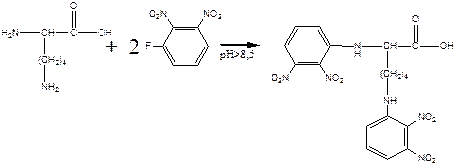
б) реакция лизина с альдегидами приводит к образованию основания Шиффа и тоже протекает по двум аминогруппам:

в) реакция с малеиновым ангидридом в слабощелочной среде:
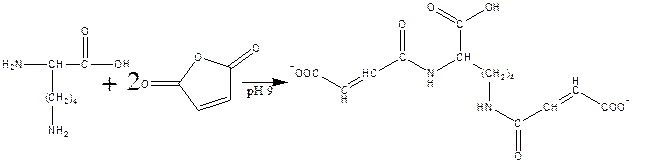
г) реакция с C2H5-S-CO-CF3, S-этил-трифторацетатом:
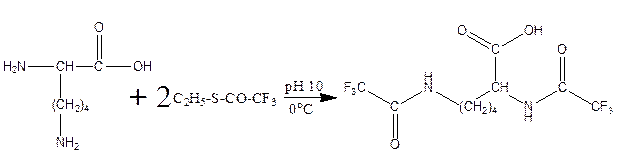
д) реакция карбамоилирования:
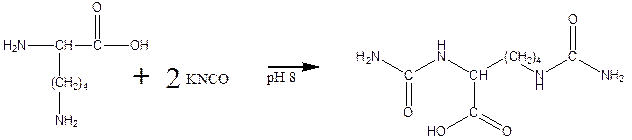
е) реакция гуанидирования:
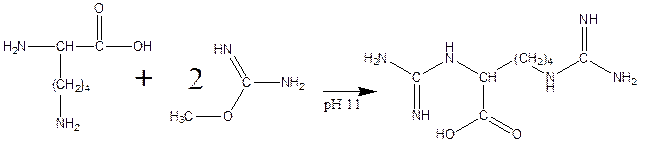
Вопрос 5.
После модификации лизинов фермент перестает их «узнавать», поэтому состав полученных пептидов изменится, и будет выглядеть следующим образом:
Ala-Leu-Gly-Lys-Ala-Arg-Gly-Gly-Lys
Arg-Ala-Leu-Gly-Lys-Ala-Arg
Gly-Gly-Lys
и аминокислота аргинин.
Вопрос 6.
Исходя из того, что трипсин гидролизует связи после аргинина и лизина, в его центр связывания могут входить аспарагиновая кислота или глутаминовая кислота, отрицательно заряженные боковые группы которых будут образовывать электростатические контакты с положительно заряженными боковыми группами субстрата.
Вопрос 7.
Поскольку вещество А дает реакцию серебряного зеркала, значит это альдегид. С учетом известной доли углерода, и предполагая, что число атомов углерода при реакции не изменилось, можно рассчитать молекулярную массу вещества А: M (A) = 12·8/0, 7164 = 134 (г/моль). Следовательно, это не просто альдегид, а дикарбонильное соединение, то есть фенилглиоксаль:
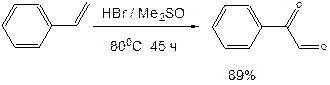
При взаимодействии фенилглиоксаля с аргинином, карбонилы реагируют с гуанидо-группой аргинина:
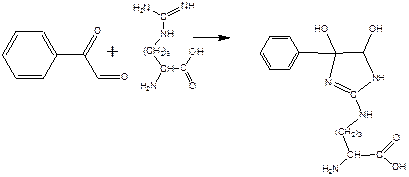
получающееся вещество не очень устойчиво, и его можно стабилизировать добавлением борной кислоты:
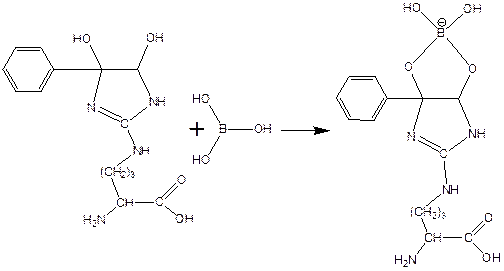
Система оценивания:
Вопрос 1а). 1 балл
Вопрос 1б). 2 балла
Вопрос 2а).2 балла
Вопрос 2б). 1 балл
Вопрос 3. 1 балл
Вопрос 4. 6 баллов, по одному баллу за каждую реакцию
Вопрос 5. 2 балла
Вопрос 6. 2 балла
Вопрос 7. 3 балла
Итого 20 баллов
|
|
