
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
За определение вещества D 2 балла
|
|
За подтверждение вещества D 2 балла.
Уравнения реакций 2 балла
Итого – 20 баллов
Задача 11-3 (автор Ерёмин В. В.)
1.
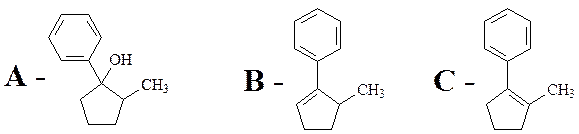
2. При равновесии скорость прямой элементарной реакции равна скорости обратной реакции:
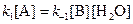
Константа равновесия имеет вид:
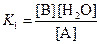
Из условия равенства скоростей находим:
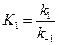
3. Вещество B образуется в первой прямой реакции и расходуется в обратной ей реакции:
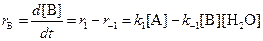
Аналогичное уравнение имеет место для вещества С:
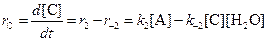
а) В начале реакции можно пренебречь обратными реакциями, и кинетические уравнения упрощаются:
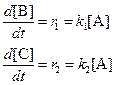
Поделив одно уравнение на другое, убеждаемся, что отношение количеств продуктов в начале реакции определяется константами скорости (кинетический контроль):
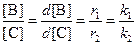
б) При равновесии концентрации реагентов и продуктов связаны выражениями для констант равновесия:
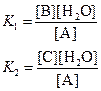
Поделив одно уравнение на другое, находим, что отношение количеств продуктов в конце реакции определяется константами равновесия (термодинамический контроль):
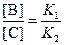
4. Правило Зайцева утверждает, что в реакциях элиминирования преимущественно образуется более замещённый алкен, в данном случае – С. В этой системе правило Зайцева определяется термодинамическим контролем, то есть устойчивостью продуктов реакции.
5. Обозначим энергии активации первой и второй прямых реакций E 1 и E 2. Из уравнения Аррениуса следует:

Запишем это соотношение два раза: при температурах T 1 и T 2 и вычтем первое из второго. Тогда константа сократится, и получим:
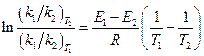
По условию,
при T 1 = 333 К k 1 / k 2 = [B] / [C] = 55/45
при T 2 = 343 К k 1 / k 2 = [B] / [C] = 50/50
Подставляя эти значения в последнюю формулу, находим:
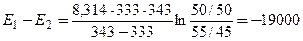 Дж/моль = –19 кДж/моль.
Дж/моль = –19 кДж/моль.
E 1 = E 2 – 19 = 61 кДж/моль.
Аналогичные расчёты, но с термодинамическими величинами, можно провести для равновесных концентраций. Обозначим энтальпии первой и второй прямых реакций D H 1 и D H 2. Из зависимости константы равновесия от температуры следует:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
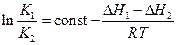
Запишем это соотношение два раза: при температурах T 1 и T 2 и вычтем первое из второго. Тогда константа сократится, и получим:
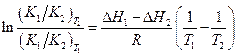
По условию,
при T 1 = 333 К K 1 / K 2 = [B] / [C] = 9/91
при T 2 = 343 К K 1 / K 2 = [B] / [C] = 11/89
Подставляя эти значения в последнюю формулу, находим:
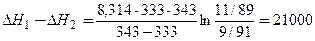 Дж/моль = 21 кДж/моль.
Дж/моль = 21 кДж/моль.
D H = D H 1 – D H 2 = 21 кДж/моль.
|
|
