
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Система оценивания. 1. Названия веществ А – И 1 балл ´ 9 = 9 баллов;
|
|
1. Названия веществ А – И 1 балл ´ 9 = 9 баллов;
2. Уравнения реакций 1–5 1 балл ´ 5 = 5 баллов;
3. Уравнения реакций Na2S2O3 с I2 и Cl2 1 балл ´ 2 = 2 балла;
4. Уравнения реакций 6–9с солями 1 балла ´ 4 = 4 балла;
Итого 20 баллов.
Задача 10-3 (автор Кебец П. А.)
1. Найдем среднюю молярную массу газовых смесей А и В: М (А) = М (В) = 18·2 =
= 36 г/моль. Эти смеси содержат в своем составе по два компонента в равных мольных соотношениях, а одним из компонентов смеси В, вызывающим помутнение известковой воды и не обесцвечивающим раствор перманганата калия, является углекислый газ (молярная масса M I = 44 г/моль):
CO2 + Ca(OH)2 ® CaCO3¯ + H2O (5)
Молярная масса МII второго компонента смеси В: 0, 5·44 + 0, 5· МII = 36 Þ МII = 28 г/моль.
Один из компонентов смеси А взаимодействует с оксидом иода (V). Эта реакция используется в аналитической химии для количественного определения оксида углерода (II), который окисляется до углекислого газа:
5CO + I2O5 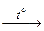 5CO2 + I2. (4)
5CO2 + I2. (4)
Таким образом, смесь А состоит из угарного газа (молярная масса 28 г/моль) и газа с молярной массой 44 г/моль (N2O, CO2, C3H8), а смесь В – из углекислого газа и газа с молекулярной массой 28 г/моль (N2, CO, C2H4, В2Н6).
Уменьшение плотности смесей А и В (до 14 × 2 = 28 г/моль) при пропускании над раскаленным углем говорит о наличии в их составе газов, проявляющих окислительные свойства в этой реакции. Такими газами могут быть N2O и СО2. Следовательно, смесь А – N2O + СО, смесь В – СО2 + N2.
N2O + C 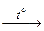 N2 + CO (3)
N2 + CO (3)
CO2 + C 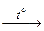 2CO (2)
2CO (2)
N2O + CO 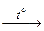 N2 + CO2 (1)
N2 + CO2 (1)
2. Структурные формулы молекул оксидов азота (I), углерода (II) и (IV), диазота:

3. Оксид азота (I) в лаборатории получают при термическом разложении нитрата аммония:
NH4NO3 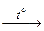 N2O + 2H2O.
N2O + 2H2O.
Для получения углекислого газа в лаборатории обычно используют взаимодействие карбонатов с минеральными кислотами, например:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
CaCO3 + 2HCl ® CaCl2 + H2O + CO2.
Угарный газ в лаборатории можно получить при взаимодействии муравьиной или щавелевой кислоты с концентрированной серной кислотой (правда, в последнем случае образуется смесь угарного и углекислого газа, поэтому для получения угарного газа в чистом виде образовавшуюся смесь пропускают через раствор щелочи):
HCOOH 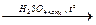 CO + H2O;
CO + H2O;
H2C2O4 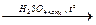 CO + CO2 + H2O.
CO + CO2 + H2O.
Молекулярный азот можно получить при нагревании раствора нитрита аммония:
NH4NO2 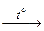 N2 + 2H2O (NH4Cl + NaNO2
N2 + 2H2O (NH4Cl + NaNO2 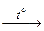 N2 + 2H2O + 2NaCl).
N2 + 2H2O + 2NaCl).
4. CO + NaOH 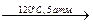 HCOONa (6)
HCOONa (6)
N2O + 2NaNH2 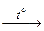 NaN3 + NaOH + NH3 (7)
NaN3 + NaOH + NH3 (7)
5. 3Mg + N2 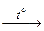 Mg3N2 (8)
Mg3N2 (8)
2Mg + CO2 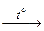 2MgO + C (9)
2MgO + C (9)
Система оценивания:
1. Составы смесей А и В 1, 5 балла ´ 2 = 3 балла;
Уравнения реакций 1–5 1 балл ´ 5 = 5 баллов;
2. Структурные формулы CO, N2O, CO2, N2 1 балл ´ 4 = 4 балла;
3. Способы получения CO, N2O, CO2, N2 1 балл ´ 4 = 4 балла;
4. Уравнения реакций 6, 7 1 балл ´ 2 = 2 балла;
5. Уравнения реакций 8, 9 1 балл ´ 2 = 2 балла;
Итого 20 баллов.
Задача 10-4 (автор Каргов С. И.)
1. Из соотношения 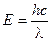 следует, что
следует, что
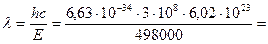 2, 40·10–7 м = 240 нм.
2, 40·10–7 м = 240 нм.
2. Согласно приведённому механизму, озон образуется по реакции 2, и скорость его образования равна k 2[O][O2][M], то есть пропорциональна концентрациям [O], [O2] и [M]. На очень большой высоте концентрация атомов кислорода O достаточно велика (поскольку велика интенсивность ультрафиолетового излучения), однако концентрации O2 и М очень малы. Напротив, на очень малой высоте, где концентрации O2 и М велики, концентрация атомов кислорода O очень мала (ультрафиолетового излучения для их образования недостаточно).
3. Молекула M поглощает выделяющуюся в реакции 2 энергию. Если бы молекулы M не было, то образовавшаяся молекула озона сразу бы снова распалась.
4. Как сказано выше, защитные свойства озонового слоя объясняются поглощением ультрафиолетового излучения. Энергия света, поглощённая в реакции 3, выделяется в виде кинетической энергии молекул в реакции 2. В результате многократного повторения реакций 2 и 3 энергия поглощённого света преобразуется в кинетическую энергию молекул, что приводит к повышению температуры.
5. Скорости реакций:
r 1 = k 1[O2], r 2 = k 2[O][O2][M], r 3 = k 3[O3], r 4 = k 4[O3][O].
Молекулы озона образуются в реакции 2, а распадаются в реакциях 3 и 4, поэтому r 2 = r 3 + r 4, или
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
k 2[O][O2][M] = k 3[O3] + k 4[O3][O].
Атомы кислорода образуются в реакциях 1 и 3 и распадаются в реакциях 2 и 4, поэтому 2 r 1 + r 3 = r 2 + r 4, или
2 k 1[O2] + k 3[O3] = k 2[O][O2][M] + k 4[O3][O].
Складывая эти два уравнения, получаем
k 1[O2] = k 4[O3][O],
откуда
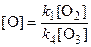 .
.
Вычитая второе уравнение из первого, получаем
k 2[O][O2][M] = k 1[O2] + k 3[O3].
Поскольку по условию k 1 / k 3 = 5, 5·10–9 и [O3] / [O2]» 10–5, то 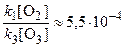 , и величиной k 1[O2] по сравнению с k 3[O3] можно пренебречь. Тогда полученное выражение упрощается:
, и величиной k 1[O2] по сравнению с k 3[O3] можно пренебречь. Тогда полученное выражение упрощается:
k 2[O][O2][M] = k 3[O3].
Подставляя 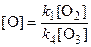 в это выражение, получаем
в это выражение, получаем
k 1 k 2[O2]2[M] = k 3 k 4[O3]2,
откуда
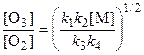 .
.
6. Подставляя численные значения, получаем
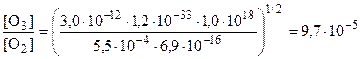 .
.
Полученная величина приблизительно в 10 раз больше экспериментально измеренного значения 10 ppm. Такое различие объясняется тем, что в цикле Чепмена учитывается только «самопроизвольный» распад молекул озона по реакциям 3 и 4. В действительности имеют место и другие механизмы распада озона, например, в присутствии NO, радикалов OH и Cl.
|
|
