
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
I.2. Кинетика односторонних реакций различных порядков.
|
|
Реакции нулевого порядка. Кинетическое уравнение реакции 0-го порядка А→ Продукты в дифференциальной форме:

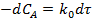
Для реакций нулевого порядка скорость реакции постоянна и не зависит от концентрации исходных веществ. Интегрирование полученного равенства приводит к уравнению
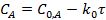
Оно выражает линейную зависимость концентрации от времени (рис.1) и позволяет определить константу скорости.
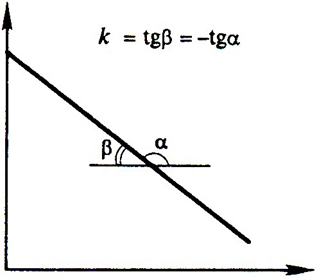
Рис.1. Зависимость концентрации от времени τ для реакции 0-го порядка (кинетическая кривая).
Выразим константу скорости

Отсюда следует, что размерность k 0 – 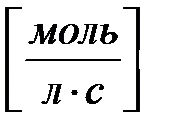
Период полупревращения (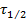 ) - это время, в течение которого концентрация исходного вещества уменьшается в два раза (
) - это время, в течение которого концентрация исходного вещества уменьшается в два раза (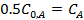 ).
).
Для реакции нулевого порядка
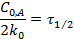
т.е. время полупревращения прямо пропорционально начальной концентрации вещества.
Реакции нулевого порядка чаще всего являются гетерофазными (т.е. протекают на границе раздела фаз).
Пример – реакция гидрирования этилена на платине:
CH2=CH2 + H2 → CH3–CH3
Скорость данной реакции определяется поверхностью катализатора и не зависит от концентраций реагентов.
Реакции первого порядка. Кинетическое уравнение реакции 1-го порядка А→ Продукты в дифференциальной форме:
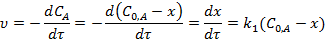
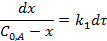
где x=C0, A-CA - количество вещества А, прореагировавшего к моменту времени τ; 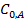 - начальная концентрация вещества А,
- начальная концентрация вещества А, 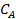 - концентрация вещества А в произвольный момент времени.
- концентрация вещества А в произвольный момент времени.
Для нахождения интеграла используем формулу:
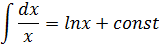
Интегральные формы кинетического уравнения реакции 1-го порядка:
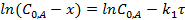
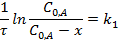
Размерность k1 – обратное время.
Зависимость натурального логарифма концентрации от времени для реакции первого порядка представлена на рисунке 2.
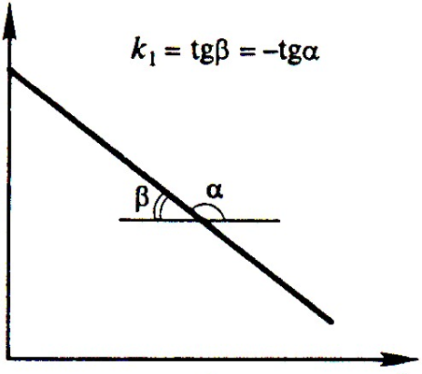
Рис.2. Зависимость натурального логарифма концентрации от времени τ для реакции первого порядка.
Концентрация продукта реакции:
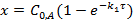
Текущая концентрация исходного вещества:
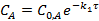
Период полупревращения не зависит от начальной концентрации:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
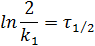
Кинетическая кривая для реакций 1 порядка имеет вид:

Если ввести долю распавшегося вещества α:
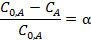
то можно получить:
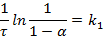
К реакциям первого порядка относятся реакции радиоактивного распада, реакции разложения сложных веществ (карбонатов, кристаллогидратов) при их нагревании, реакции изомеризации и др.
2N2O5 → O2 + 4NO2
Реакции второго порядка. Кинетическое уравнение реакции 2-го порядка А+B→ Продукты в дифференциальной форме:
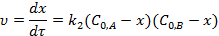
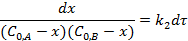
Для случая 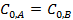 :
:
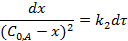
Для нахождения интеграла используем формулу:
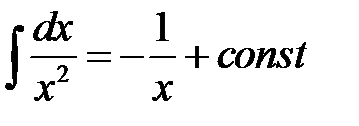
Интегральные формы кинетического уравнения реакции 2-го порядка:
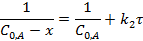

Размерность константы скорости реакции второго порядка - 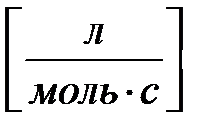 .
.
Зависимость обратной концентрации от времени для реакции второго порядка представлена на рисунке 3.
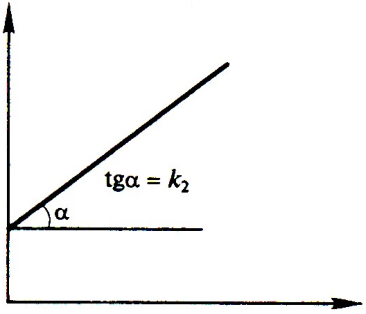
Рис. 3. Зависимость обратной концентрации от времени τ для реакции второго порядка.
Концентрация продукта реакции:
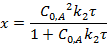
Для реакции второго порядка время полупревращения обратно пропорционально начальной концентрации веществ.
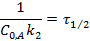
Для случая 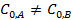 :
:

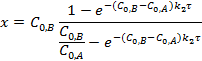
К реакциям второго порядка относятся радикальные реакции, реакция газофазного образования иодоводорода, разложения оксида азота и др.
Зависимость концентрации от времени для реакций разных порядков представлена на рисунке 4.
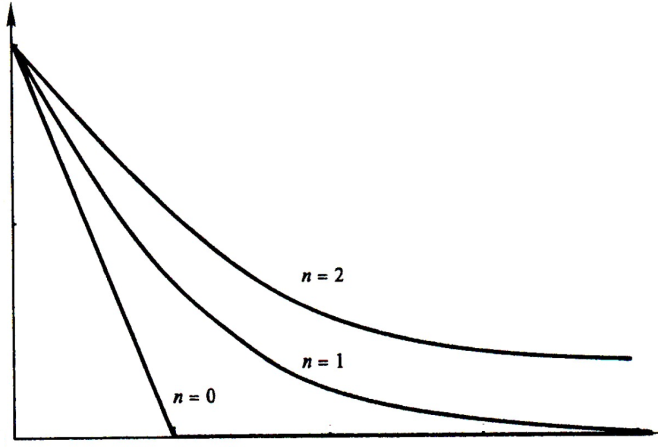
Рис. 4. Зависимость концентрации от времени τ для реакций разных порядков.
Реакции n-го порядка. Кинетическое уравнение реакции n -го порядка А1+А2+А3+…+Ап → Продукты, если все реагенты присутствуют в равных количествах и взаимодействуют в эквивалентных соотношениях в дифференциальной форме:
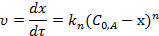

где п≠ 1 - общий порядок реакции.
Интегральные формы кинетического уравнения реакции n -го порядка:

Размерность константы скорости реакции n-го порядка – 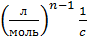 . Интегральное уравнение в прямолинейных координатах:
. Интегральное уравнение в прямолинейных координатах:

Зависимость обратной концентрации от времени для реакции n-го порядка представлена на рисунке.
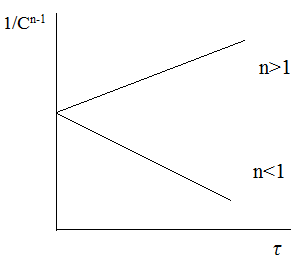
Выражения для периода полупревращения и концентрации продукта реакции:
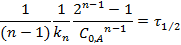
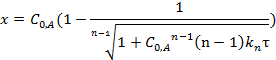
|
|
