
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
I. Феноменологическая кинетика
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ
«МОГИЛЕВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
им. А.А. КУЛЕШОВА»
Химическая кинетика и катализ
Клебанов А.В., Горанчук О.В.
МОГИЛЕВ 2013
I. ФЕНОМЕНОЛОГИЧЕСКАЯ КИНЕТИКА
Термодинамика позволяет с большой точностью предсказать принципиальную возможность протекания процесса (dG< 0) и конечное состояние системы (К), однако она не дает никаких сведений о способах фактической реализации процесса и времени его протекания. Иногда реакция термодинамически возможна, но вместе с тем она протекает бесконечно медленно, и тогда с точки зрения практики можно сказать, что она невозможна.
Например, все органические вещества, согласно принципам термодинамики, должны были бы окисляться в углекислоту и воду молекулярным кислородом воздуха, так как этот процесс сопровождался бы значительным уменьшением энергии Гиббса. Существование растений, животных, залежей угля, нефти и т. д. обязано тем, что реакция окисления в действительности протекает исключительно медленно.
Другой пример: реакция прямого получения аммиака из водорода и азота, которая используется в промышленности, является обратимой. Так как она экзотермична, то смещению равновесия в сторону продукта способствует уменьшение температуры, но технологический процесс ведут при нагревании до порядка 500 °С. Это приводит к существенному увеличению скорости процесса и результирующий выход аммиака за единицу времени увеличивается.
Химическая кинетика – раздел физической химии изучающий закономерности протекания химических процессов во времени. Химическая кинетика устанавливает законы, определяющие скорость химических процессов, и выясняет роль различных факторов, влияющих на скорость и механизм реакций.
Практическое значение ее очевидно, т.к. только зная законы кинетики и механизм реакций можно управлять химическими процессами. От скорости химической реакции зависит производительность труда и аппаратуры. Таким образом, химическая кинетика, как и термодинамика, является теоретической основой химической технологии.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Химическая кинетика состоит из разделов: 1) формальная кинетика, дающая математическое описание скорости реакции без учета механизма самой реакции. 2) Вычисление констант скоростей и энергий активации реакции по структурным и термодинамическим данным - теоретическая кинетика. 3) Описание закономерностей протекания химических процессов при тепло- и массопереносе - макрокинетика.
Задачи химической кинетики:
· расчет скоростей реакций и определение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени (прямая задача);
· определение механизмов реакций по кинетическим кривым (обратная задача).
Этапыкинетического исследования в формальной кинетике:
1. Анализ реакционной смеси и написание уравнения химической реакции.
2. Измерение зависимости химического состава реакционной смеси от времени.
3. Количественное изучение влияния различных параметров на скорость реакции (температуры, концентрации и т.д.)
4. Наблюдение особенностей протекания реакции (окраска, ускорение, замедление и т.д.)
5.Анализ данных и нахождение кинетических закономерностей, характеризующие данную реакцию (концентрация – время, скорость – концентрация, скорость – физико-химические параметры).
Различия между химической термодинамикой и кинетикой:
1. В химической термодинамике нет времени, она предсказывает только конечный результат процесса. Химическая кинетика изучает только изменяющиеся (динамические) системы.
2. Для термодинамики важны левая и правая части химического уравнения. Равновесные свойства определяются состоянием как исходных веществ, так и продуктов реакции. Для кинетики важна только левая часть уравнения реакции. Скорость реакции определяется только состоянием исходных веществ.
3. Термодинамические свойства определяются термодинамической активностью веществ, кинетические свойства - их концентрацией.
I.1. Основные понятия и определения
В процессе развития экспериментальных и теоретических основ химической кинетики сформировались понятия, специфические для этого раздела физической химии.
Если реакция протекает путем прямого превращения молекул исходных веществ в молекулы продуктов реакции, то такая реакция называется элементарной. Она является совокупностью большого числа однотипных элементарных актов химического превращения. Элементарным химическим актом называется единичное взаимодействие частиц (молекул, радикалов, ионов, атомов и др.), в результате которого образуются новые частицы продуктов реакции или промежуточных соединений.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Число молекул, участвующих в элементарном химическом акте, называется молекулярностью реакции. Молекулярность реакции - всегда целое положительное число: 1, 2, реже 3 (соответственно моно-, би- и тримолекулярные реакции). Элементарных химических актов с одновременным участием четырех молекул не бывает, так как вероятность одновременного столкновения четырех молекул ничтожно мала.
1. Мономолекулярные реакции – элементарные реакции распада и изомеризации, в которых участвует только одна молекула:
CH3Br = CH3 + Br.
2. Бимолекулярные реакции – самый распространенный тип элементарных реакций. В такихреакциях происходит столкновение двух частиц:
H. +Br2=HBr + Br.
3. В тримолекулярных реакциях одновременно сталкиваются три молекулы, например:
2NO + O2 =2NO2.
Большинство химических реакций не являются элементарными, а включают несколько элементарных стадий химического превращения. Такие реакции называются сложными. Реакция H2 + Br2=2HBr протекает не путем прямого взаимодействия молекул водорода и брома с образованием двух молекул бромида водорода, а включает следующие элементарные стадии:
Br2=Br. + Br.
Br. +H2=HBr + H.
H. +Br2=HBr + Br.
Br. + Br.=Br2
В каждой из них может принимать участие одна или две частицы, а некоторые из них протекают как в прямом, так и обратном направлениях.
При протекании сложной химической реакции возникают частицы (атомы, молекулы, ионы), которые далее реагируют с образованием продуктов реакции. Такие частицы называются промежуточными. Если промежуточные частицы достаточно устойчивы, то они могут быть выделены из системы в форме индивидуального вещества, которое называют промежуточным.
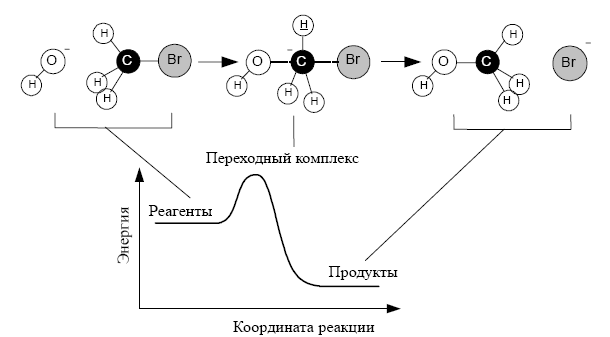
Совокупность элементарных реакций называют механизмом сложной реакции. По уравнению химической реакции нельзя определить, является реакция элементарной или сложной. Уравнение реакции это химизм реакции.
Реакционное пространство. Физико-химические процессы могут протекать в системах, состоящих из одной или нескольких фаз. Химическая реакция, протекающая в пределах одной фазы, называется гомогенной. Реакционным пространством в этом случае является жидкая, газообразная или твердая фаза системы. Химическая реакция, протекающая на границе раздела двух фаз, называется гетерогенной, а реакционное пространство есть поверхность раздела фаз. Количество вещества, реагирующего за единицу времени, всегда пропорционально величине реакционного пространства - объему фазы или площади поверхности раздела фаз.
Скорость элементарной реакции есть число однотипных элементарных актов химического превращения, совершающихся в единицу времени в единице объема или на единице поверхности реакционного пространства. Непосредственно определить число элементарных актов, совершающихся при протекании химической реакции, невозможно. Поэтому скорость реакции обычно выражают через величину, пропорциональную числу элементарных актов, - количества вещества, реагирующего или образующегося за счет реакции в единицу времени в единице объема реакционного пространства. Однако изменение количества вещества в реакционном пространстве может быть обусловлено как протеканием реакции, так и обменом веществом с окружающей средой. Поэтому следует рассматривать отдельно закрытые и открытые системы.
В закрытой системе изменение количества вещества с течением времени происходит только за счет протекания в ней химической реакции.
Для гомогенной химической реакции:
ν 1 A1 + ν 2 A2 → ν 3 A3 + ν 4 A4
изменения числа молей не являются независимыми, а связаны стехиометрическим соотношением:
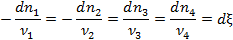
где ν i – стехиометрический коэффициент i -го вещества, ξ – химическая переменная (степень протекания реакции, число пробегов реакции).
Скорость гомогенной химической реакции выражается соотношением:
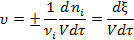
где V – реакционный объем, τ – время.
Если реакционный объем не изменяется
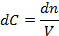
тогда истинная скорость реакции равна:
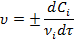
Скорость реакции по данному веществу:
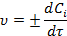
Средняя скорость реакции:
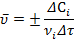
Размерность скорости реакции - моль/(л.с). По определению, скорость величина положительная, поэтому для исходных веществ производная берется со знаком минус, а для конечных - со знаком плюс.
Для сложной реакции в закрытой системе понятие скорости реакции в целом теряет смысл и можно говорить лишь о скорости образования или расходования реагентов, а также о скоростях отдельных стадий.
|
|
