
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Измерение скорости реакции.
|
|
Для экспериментального определения скорости гомогенной реакции в закрытой системе измеряют концентрацию любого реагента сi в различные моменты времени. Полученные данные представляют в виде экспериментальной зависимости сi=f(t) которая называется кинетической кривой.
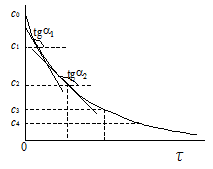
Проводят касательные, тангенс угла наклона которых равен dci/dt. Видно, что скорость реакции уменьшается со временем по мере уменьшения концентрации реагента.
Для получения кинетической кривой применяются любые методы, позволяющие либо непосредственно определять изменение количеств веществ со временем, либо измерять меняющегося со временем физическое свойство системы. Изменение физико-химического свойства должно быть пропорционально изменению количества вещества.
Факторы, влияющие на скорость реакции.
На скорость реакции существенное влияние оказывают концентрации реагирующих веществ, давление в системе (для газовых реакций), температура, природа растворителя, а для многокомпонентных растворителей - их состав.
Скорость большинства реакций увеличивается в присутствии катализаторов. Такие реакции называют каталитическими. Некоторые реакции инициируются при воздействии на реакционную смесь видимого света или ультрафиолетового излучения. Скорость таких реакций возрастает с увеличением интенсивности облучения. Такие реакции называются фотохимическими. К числу факторов, вызывающих и ускоряющих химические реакции, относятся все виды радиоактивного излучения. Такие реакции называются радиационно-химическими. Если пропускать электрический ток через раствор электролита, то на электродах будут протекать различные электрохимические реакции, скорость которых зависит от химической природы электродов, электродного потенциала, состава электролита. При пропускании электрического тока через газоразрядные трубки в них возникает частично ионизированный газ - низкотемпературная плазма. Реакции, протекающие в условиях газового разряда, называются плазмохимическими. Реакции, протекающие в твердых телах, могут инициироваться и ускоряться при интенсивном механическом воздействии на частицы твердого тела (трение, удар) в специальных диспергаторах. Это механохимические реакции.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Таким образом, в настоящее время в химической технологии могут использоваться различные методы воздействия на химическую систему с целью инициирования реакции, увеличения скорости и изменения направления ее протекания.
Количественное описание скорости реакции в зависимости от концентрации реагирующих веществ базируется на основном постулате химической кинетики и составляет предмет формальной кинетики.
Закон действующих масс или основной постулат химической кинетики (К. Гульдберг и П. Вааге) - скорость элементарной химической реакции пропорциональна произведению концентраций реагентов возведенных в некоторую степень:
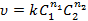
Константа скорости k численно равна скорости реакции при концентрациях, равных единице. Для элементарных реакций константа скорости не зависит от концентрации (по определению) и времени в отличие от скорости реакции. По известным величинам k сравнивают скорости различных реакций. Размерность константы скорости зависит от порядка реакции.
Для сложных реакций экспериментально измеряемая константа скорости является комбинацией констант скорости отдельных стадий и, кроме того, может зависеть не только от температуры, но и от концентрации.
Показатели степени при концентрациях, входящих в кинетическое уравнение скорости химической реакции (ni) называются порядком реакции по данному реагенту, а сумму порядков реакции (показателей степени) по всем реагентам называют порядком реакции(n=n1+n2). Порядок реакций определяют только опытным путем. Для элементарных реакций порядок по веществу совпадает со стехиометрическим коэффициентом. Порядок сложной реакции по веществу, в общем случае, никак не связан со стехиометрическими коэффициентами в уравнении реакции и может меняться, в зависимости от условий протекания процесса.
Порядок реакции может быть положительным или отрицательным, целым или дробным, нулевым. Порядок и молекулярность совпадают лишь для простых одностадийных реакций.
|
|
