
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
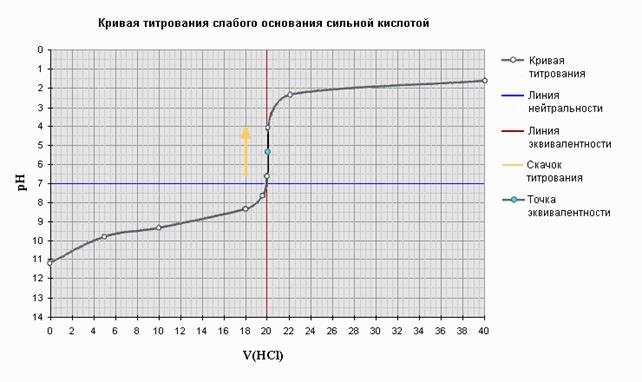
Построение кривой титрования слабого основания сильной кислотой
|
|
Задание. Построить кривую титрования 20 мл 0, 1н раствора NH3× H2O раствором HCl той же концентрации.
NH3× H2O + HCl = NH4Cl + H2O
 |
1. 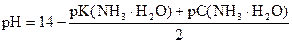
K(NH3× H2O) = 1, 76× 10-5
pK(NH3× H2O) = - lg 1, 76× 10-5 = (- lg 1, 76) + (- lg 10-5) = 5 - 0, 25 = 4, 75
pС(NH3× H2O) = - lg 0, 1 = - lg 10-1 = 1
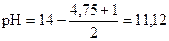
2. В растворе буферная смесь: недотитрованное основание и его соль. Гидролиз соли подавлен.
 |
pН = 14 - (pK(NH3× H2O) + pС(NH3× H2O) - pС(NH4Cl))
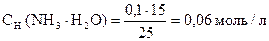
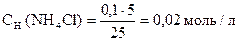
pС(NH3× H2O) = - lg 0, 06 = - lg 6× 10-2 = (- lg 6) + (- lg 10-2) = 2 - 0, 78 = 1, 22
pС(NH4Cl) = - lg 0, 02 = - lg 2× 10-2 = (- lg 2) + (- lg 10-2) = 2 - 0, 3 = 1, 7
pН = 14 - (4, 75 + 1, 22 - 1, 7) = 9, 73
3. 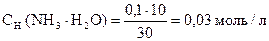
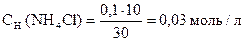
pС(NH3× H2O) = - lg 0, 03 = - lg 3× 10-2 = (- lg 3) + (- lg 10-2) = 2 - 0, 48 = 1, 52
pС(NH4Cl) = - lg 0, 03 = - lg 3× 10-2 = (- lg 3) + (- lg 10-2) = 2 - 0, 48 = 1, 52
pН = 14 - (4, 75 + 1, 52 - 1, 52) = 9, 25
4. 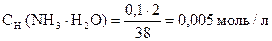
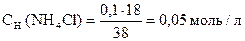
pС(NH3× H2O) = - lg 0, 005 = - lg 5× 10-3 = (- lg 5) + (- lg 10-3) = 3 - 0, 7 = 2, 3
pС(NH4Cl) = - lg 0, 05 = - lg 5× 10-2 = (- lg 5) + (- lg 10-2) = 2 - 0, 7 = 1, 3
pН = 14 - (4, 75 + 2, 3 - 1, 3) = 8, 25
5. 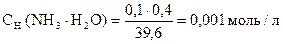
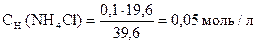
pС(NH3× H2O) = - lg 0, 001 = - lg 10-3 = 3
pС(NH4Cl) = - lg 0, 05 = - lg 5× 10-2 = (- lg 5) + (- lg 10-2) = 2 - 0, 7 = 1, 3
pН = 14 - (4, 75 + 3 - 1, 3) = 7, 55
6. 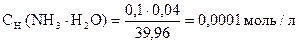
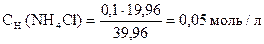
pС(NH3× H2O) = - lg 0, 0001 = - lg 10-4 = 4
pС(NH4Cl) = - lg 0, 05 = - lg 5× 10-2 = (- lg 5) + (- lg 10-2) = 2 - 0, 7 = 1, 3
pН = 14 - (4, 75 + 4 - 1, 3) = 6, 55
7. В растворе при эквивалентном количестве кислоты и щелочи образуется NH4Cl. Соль подвергается гидролизу.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
 |
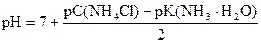
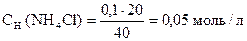
pС(NH4Cl) = - lg 0, 05 = - lg 5× 10-2 = (- lg 5) + (- lg 10-2) = 2 - 0, 7 = 1, 3
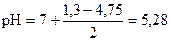
8. Пока в растворе содержится избыток кислоты, рН раствора зависит от этой кислоты.
 |
рН = pС(HCl)
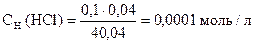
рН = - lg 0, 0001 = - lg 10-4 = 4
9. 
pН = - lg 0, 005 = - lg 5× 10-3 = (- lg 5) + (- lg 10-3) = 3 - 0, 7 = 2, 3
| № | Прибавление | Избыток (мл) | СН(NH3× H2O), | СН(NH4Cl), | СН(HCl), | Расчетная | рН | |
| HCl (мл) | NH3× H2O | HCl | моль/л | моль/л | моль/л | формула | ||
| - | 0, 1 | - | - | 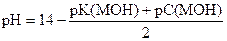
| 11, 12 | |||
| 5, 00 | - | 0, 06 | 0, 02 | - | pН = 14 - (pK(MOН) + pС(MOН) - pС(MА)) | 9, 73 | ||
| 10, 00 | - | 0, 03 | 0, 03 | - | pН = 14 - (pK(MOН) + pС(MOН) - pС(MА)) | 9, 25 | ||
| 18, 00 | - | 0, 005 | 0, 05 | - | pН = 14 - (pK(MOН) + pС(MOН) - pС(MА)) | 8, 25 | ||
| 19, 60 | 0, 4 | - | 0, 001 | 0, 05 | - | pН = 14 - (pK(MOН) + pС(MOН) - pС(MА)) | 7, 55 | |
| 19, 96 | 0, 04 | - | 0, 0001 | 0, 05 | - | pН = 14 - (pK(MOН) + pС(MOН) - pС(MА)) | 6, 55 | |
| 20, 00 | - | - | - | 0, 05 | - | 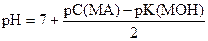
| 5, 28 | |
| 20, 04 | - | 0, 04 | - | - | 0, 0001 | рН = рС(НА) | ||
| 22, 00 | - | - | - | 0, 005 | рН = рС(НА) | 2, 3 |
|
|
