
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вычисление рН в растворах солей, подвергающихся гидролизу
|
|
а) В растворе соли слабой кислоты и сильного основания
 |
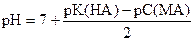
Пример расчета. Вычислить рН в 0, 01н растворе CH3COOK.
| Дано: Сн (CH3COOK) = 0, 01 моль/л K (CH3COOН) = 1, 74× 10-5 |
| рН =? |
Решение:
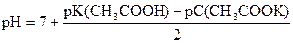
pK(CH3COOН) = - lg 1, 74× 10-5 = (- lg 1, 74) + (- lg 10-5) = 5 - 0, 24 = 4, 76
pС(CH3COOK) = - lg 0, 01 = - lg 10-2 = 2
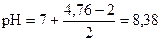
среда слабощелочная
б) В растворе соли слабого основания и сильной кислоты
 |
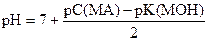
Пример расчета. Вычислить рН в 0, 05н растворе NH4Br.
| Дано: Сн (NH4Br) = 0, 05 моль/л K (NH4Br) = 1, 76× 10-5 |
| рН =? |
Решение:
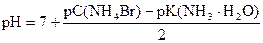
pK(NH3× H2O) = - lg 1, 76× 10-5 = (- lg 1, 76) + (- lg 10-5) = 5 - 0, 25 = 4, 75
pС(NH4Br) = - lg 0, 05 = (- lg 5) + (- lg 10-2) = 2 - 0, 7 = 1, 3
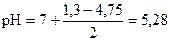
среда слабокислая
2.7. Таблица формул для вычисления концентрации ионов Н+ и рН в водных растворах
| Раствор | С(Н+), моль/л | рН |
| Сильная кислота | С(Н+) = С(НА) | рН = рС(НА) |
| Сильное основание | 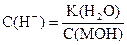
| рН = 14 - рС(МОН) |
| Слабая кислота | 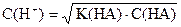
| 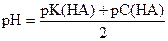
|
| Слабое основание | 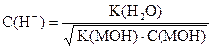
| 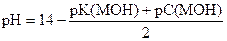
|
| Слабая кислота в присутствии ее солей | 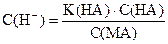
| pН = pK(НА) + pС(НА) - pС(MА) |
| Слабое основание в присутствии его солей | 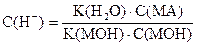
| pН = 14 - (pK(MOН) + pС(MOН) - pС(MА)) |
| Соль сильного основания и слабой кислоты | 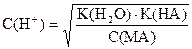
| 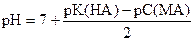
|
| Соль сильной кислоты и слабого основания | 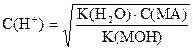
| 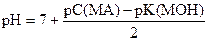
|
|
|
