
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Водородный и гидроксильный показатели
|
|
Водородный показатель обозначают pH.
pH – это отрицательный десятичный логарифм концентрации ионов водорода.
pH = - lg C(H+)
Гидроксильный показатель обозначают pOH.
pOH – это отрицательный десятичный логарифм концентрации ионов гидроксила.
pOH = - lg C(OH-)
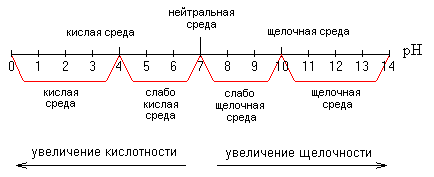
Характеристика среды
| 1) Нейтральная среда | pH = 7 |
| 2) Кислая среда | pH < 7 |
| 3) Щелочная среда | pH > 7 |
2.3. Равновесие концентраций H+ и OH- в водных растворах
| 1) Нейтральная среда | С(H+) = C(OH-) = 10-14 моль/л |
| 2) Кислая среда | С(H+) > C(OH-) С(H+) > 10-7 моль/л (10-6; 10-5 и т.д.) |
| 3) Щелочная среда | С(H+) < C(OH-) С(H+) < 10-7 моль/л (10-8; 10-9 и т.д.) |
Если в растворе известна концентрация одного из ионов, то можно вычислить концентрацию другого иона:
| С(H+) × C(OH-) = 10-14 | 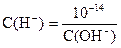
| 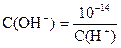
|
Шкала рН
С(H+) × C(OH-) = 10-14
(- lg С(Н+)) + (- lg С(OH-)) = - lg 10-14
рН + рОН = 14
Вывод формул для вычисления рН
|
|
