
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Додатки
|
|
Додаток 1
Стандартні ентальпії 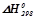 , ентропії
, ентропії  і енергії Гіббса
і енергії Гіббса 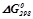 утворення деяких речовин при
утворення деяких речовин при 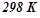 (
(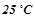 )
)
| № з/п | Речовина | Агрегатний стан | 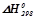 кДж/моль
кДж/моль
|  Дж/моль К
Дж/моль К
| 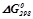 кДж/моль
кДж/моль
|
| Al2O 3 | крист. | -1676, 0 | 50, 9 | -1562, 0 | |
| C(графіт) | крист. | 5, 7 | |||
| CH 4 | газ | -74, 9 | 186, 2 | -50, 8 | |
| C 2 H 2 | газ | 226, 8 | 200, 8 | 209, 2 | |
| CO | газ | -110, 5 | 197, 5 | -137, 1 | |
| CO 2 | газ | -393, 5 | 213, 7 | -394, 4 | |
| CaCO 3 | крист. | -1207, 0 | 88, 7 | -1127, 7 | |
| CaO | крист. | -635, 5 | 39, 7 | -604, 2 | |
| Ca (OH)2 | крист. | -986, 6 | 76, 1 | -896, 8 | |
| Cr 2 O 3 | крист. | -1440, 6 | 81, 2 | -1050, 0 | |
| CuO | крист. | -162, 0 | 42, 6 | -129, 9 | |
| FeO | крист. | -264, 6 | 60, 8 | -244, 3 | |
| Fe 2 O 3 | крист. | -822, 2 | 87, 4 | -740, 3 | |
| H 2 O | газ | -241, 8 | 188, 7 | -228, 6 | |
| H 2 O | рід. | -285, 8 | 70, 1 | -237, 3 | |
| N 2 | газ | 191, 5 | |||
| NO | газ | 90, 3 | 210, 6 | 86, 6 | |
| O 2 | газ | 205, 0 | |||
| PbO | крист. | -219 | 66, 1 | -189, 1 | |
| Ti | крист. | 80, 6 | |||
| TiO 2 | крист. | -943, 9 | 50, 2 | -888, 6 | |
| P 2 O 5 | крист. | -1492 | 114, 5 | -1348, 8 | |
| Сl2 | газ | 222, 9 | |||
| HCl | газ | -91, 8 | 186, 8 | -94, 8 |
Додаток 2
Константи дисоціації деяких кислот і основ у водних розчинах
| Тип ел-літу | Назва сполуки | Формула | Константи дисоціації | ||
| К1 | К2 | К3 | |||
| Кислоти неорганічні | Йодидна | HJ | 1011 | ||
| Бромідна | HBr | 109 | |||
| Хлоридна | HCl | 107 | |||
| Сульфатна | H2SO4 | 103 | 10-2 | ||
| Манганатна | HMnO4 | 2∙ 102 | |||
| Нітратна | HNO3 | 43, 6 | |||
| Хроматна | H2CrO4 | 1, 8∙ 10-1 | 3, 2∙ 10-7 | ||
| Сульфітна | H2SO3 | 1, 3∙ 10-2 | 6, 3∙ 10-8 | ||
| Ортофосфатна | H3PO4 | 7, 5∙ 10-3 | 6, 2∙ 10-8 | 2, 2∙ 10-13 | |
| Арсенатна | H3AsO4 | 5, 6∙ 10-3 | 1, 1∙ 10-7 | 2, 95∙ 10-12 | |
| Фторидна | HF | 7∙ 10-4 | |||
| Нітритна | HNO2 | 4∙ 10-4 | |||
| Карбонатна | H2CO3 | 4, 3∙ 10-7 | 5, 6∙ 10-11 | ||
| Сульфідна | H2S | 1, 05∙ 10-7 | 1, 23∙ 10-13 | ||
| Ціанідна | HCN | 7, 2∙ 10-10 | |||
| Арсенітна | H3AsO3 | 5, 8∙ 10-10 | 3∙ 10-14 | ||
| Боратна | H3BO3 | 5, 7∙ 10-10 | 1, 8∙ 10-13 | 1, 6∙ 10-14 | |
| Кислоти органічні | Оксалатна | H2C2O4 | 5, 9∙ 10-2 | 6, 4∙ 10-5 | |
| Мурашина | HCOOH | 1, 77∙ 10-4 | |||
| Оцтова | CH3COOH | 1, 76∙ 10-5 | |||
| Основи | Натрій гідроксид | NaOH | 5, 9 | ||
| Літій гідроксид | LiOH | 6, 75∙ 10-1 | |||
| Барій гідроксид | Ba(OH)2 | 2, 3∙ 10-1 | |||
| Магній гідроксид | Mg(OH)2 | 2, 5∙ 10-3 | |||
| Кальцій гідроксид | Ca(OH)2 | 4, 3∙ 10-2 | |||
| Ферум (ІІ) гідроксид | Fe(OH)2 | 1, 3∙ 10-4 | |||
| Ферум (ІІІ) гідроксид | Fe(OH)3 | 1, 8∙ 10-11 | |||
| Манган (ІІ) гідроксид | Mn(OH)2 | 5, 0∙ 10-4 | |||
| Амоній гідроксид | NH4OH | 1, 79∙ 10-5 | |||
| Вода | H2O | 1, 8∙ 10-16 |
Додаток 3
Розчинність у воді кислот, основ та солей
| Катіони | Аніони | ||||||||||||
| ОН - | F - | Cl - | Br - | I - | S 2- | SO32- | SO4 2- | NO3 - | PO4 3- | CO3 2- | SiO3 2- | CH3СOO - | |
| H+ | Р | P | P | P | P | P | P | P | P | P | H | P | |
| NH4+ | Р | Р | P | P | P | Р | P | P | P | P | P | - | P |
| Na+ | P | P | P | P | P | P | P | P | P | P | P | P | P |
| K+ | P | P | P | P | P | P | P | P | P | P | P | P | P |
| Li+ | P | P | P | P | P | P | P | P | P | H | P | P | P |
| Мg2+ | M | Н | P | P | P | P | H | P | P | H | H | H | P |
| Ca2+ | M | Н | P | P | P | M | H | M | P | H | H | H | P |
| Ba2+ | P | М | P | P | P | P | H | H | P | H | H | H | P |
| Al3+ | H | H | P | P | P | - | - | P | P | H | - | H | M |
| Cr3+ | H | H | P | P | P | - | - | P | P | H | - | H | P |
| Zn2+ | H | М | P | P | P | H | H | P | P | H | H | H | P |
| Mn2+ | H | М | P | P | P | H | H | P | P | H | H | H | P |
| Ni2+ | H | Р | P | P | P | H | H | P | P | H | H | H | P |
| Fe2+ | H | H | P | P | P | H | H | P | P | H | H | H | P |
| Fe3+ | H | H | P | P | P | H | - | P | P | H | - | H | P |
| Co2+ | H | Р | P | P | P | H | H | P | P | H | H | - | P |
| Cd2+ | H | М | P | P | P | H | H | P | P | H | H | H | P |
| Hg2+ | - | - | P | M | H | H | H | P | P | H | H | - | P |
| Hg+ | - | - | H | H | H | H | - | M | P | H | H | - | M |
| Cu2+ | H | H | P | P | P | H | H | P | P | H | - | - | P |
| Sn2+ | H | Р | P | P | P | H | - | P | Р | H | - | - | P |
| Pb2+ | H | H | M | M | H | H | H | H | P | H | H | H | P |
| Ag+ | - | Р | H | H | H | H | - | M | P | H | H | - | M |
Використані позначення:
P – розчиняється у воді.
М– мало розчиняється у воді.
Н – практично не розчиняється.
Риска– сполука розкладається водою або не існує.
Додаток 4
Стандартні електродні потенціали металів
(електрохімічний ряд напруг)
| Електрод | j 0, В | Електрод | j 0, В |
| Li+/Li | - 3, 04 | Cd 2+/ Cd | - 0, 40 |
| Rb +/ Rb | - 2, 92 | Co 2+/ Co | - 0, 28 |
| K +/ K | - 2, 92 | Ni 2+/ Ni | - 0, 25 |
| Ba 2+/ Ba | - 2, 90 | Sn 2+/ Sn | - 0, 14 |
| Ca 2+/ Ca | - 2, 87 | Pb 2+/ Pb | - 0, 13 |
| Na +/ Na | - 2, 71 | 2 H +/ H 2 | - 0, 00 |
| Mg 2+/ Mg | - 2, 37 | Sb 3+/ Sb | + 0, 20 |
| Al 3+/ Al | - 1, 70 | Bi 3+/ Bi | +0, 21 |
| Ti 2+/ Ti | - 1, 60 | Cu 2+/ Cu | + 0, 34 |
| Zr 4+/ Zr | - 1, 58 | Ag +/ Ag | + 0, 80 |
| Mn 2+/ Mn | - 1, 18 | Hg 2+/ Hg | + 0, 85 |
| Cr 2+/ Cr | - 0, 91 | Pt 2+/ Pt | + 1, 19 |
| Zn 2+/ Zn | - 0, 76 | Au 3+/ Au | + 1, 50 |
| Cr 3+/ Cr | - 0, 74 | Au +/ Au | + 1, 70 |
| Fe 2+/ Fe | - 0, 44 |
Додаток 5
Взаємодія з кислотами HCl, H2SO4, HNO3 металів
| Кислота | Окисник | Продукт реакції | Які метали взаємодіють |
| Конц. HСl Розв. | Н+ | Сіль, Н2 | Усі метали, що розміщені ліворуч Н2 |
| Розв. H2SO4 Конц. | Н+ | Сіль, Н2 | Усі метали, що розміщені ліворуч Н2 |
| S+6 | Сіль, вода, SO2 | Малоактивні метали від Fe, Co, Cr пасивуються | |
| Сіль, вода, H2S або S | Активні метали до Cr, Al пасивуються | ||
| Розв. HNO3 Конц. | N+5 | Сіль, вода, NO | Малоактивні метали від Cr до Pt |
| N+5 | Сіль, вода, N2O або N2, або NH4NO3 | Активні метали до Cr | |
| Сіль, вода, NO2 | Усі метали, окрім Pt, Au; Al, Fe, Co, Ni пасивуються |
Додаток 6
Розповсюджені назви деяких речовин
| Назва | Склад |
| Алебастр | CaSO4∙ 0, 5H2O або 2 CaSO4∙ H2O |
| Аміачна вода (нашатирний спирт) | NH4OH |
| Апатит (мінерал) | 3Ca3(PO4)2∙ Ca(F, Cl)2 |
| Азбест | 3MgO∙ CaO∙ 4SiO2 |
| Барит | BaSO4 |
| Баритова вода | Ba(OH)2 (водний розчин) |
| Берлінська лазур | Fe4[Fe(CN)6]3 |
| Бертолетова сіль | KClO3 |
| Боксит | Al2O3∙ 2H2O |
| Бордоська рідина | Суміш водного розчину CuSO4 з вапняним молоком |
| Бура | Na2B4O7∙ 10H2O |
| “Веселящий газ” | N2O |
| Вапно: гашене натронне негашене хлорне | Ca(OH)2 2CaO + NaOH CaO CaOCl2 |
| Вапняне молоко (вапняна вода) | Ca(OH)2 – водна суспензія |
| Вуглекислий газ | CO2 |
| Галеніт, кам’яна сіль, кухонна сіль | NaCl |
| Гіпс (мінерал) | CaSO4∙ 2H2O |
| Глауберова сіль | Na2SO4∙ 10H2O |
| Гірка сіль | MgSO4∙ 7H2O |
| Доломіт | MgCO3∙ CaCO3 |
| Їдке калі | KOH |
| Їдкий натр | NaOH |
| Каломель | Hg2Cl2 |
| Кальцит | CaCO3 |
| Каолін (біла глина) | Al2O3∙ 2SiO2∙ 2H2O |
| Карналіт | KCl∙ MgCl2∙ 6H2O |
| Кварц, пісок | SiO2 |
| Кіновар | HgS |
| Кріоліт | AlF3∙ 3NaF |
| Кров’яна сіль: жовта червона | K4[Fe(CN)6] K3[Fe(CN)6] |
| Купорос: мідний залізний цинковий | CuSO4∙ 5H2O FeSO4∙ 7H2O ZnSO4∙ 7H2O |
| Купоросне масло | H2SO4 (90, 5 – 92, 5%) |
| Магнезія біла | MgO |
| Магнітний залізняк (магнетит) | Fe3O4 або FeO∙ Fe2O3 |
| Мармур, вапняк, крейда | CaCO3 |
| Нашатир | NH4Cl |
| Олеум | Розчин (15, 5 – 60%) SO3 в H2SO4 |
| Пергідроль | H2O2 (27 – 31%-ний розчин) |
| Пірит, сірчистий колчедан | FeS2 |
| Плавикова кислота | HF |
| Плавиковий шпат | CaF2 |
| Поташ | K2CO3 |
| Преципітат | CaHPO4∙ 2H2O |
| Сегнетова сіль | KNaC4H4O6 |
| Селітра: аміачна калійна (індійська) натрієва (чилійська) кальцієва (норвезька) | NH4NO3 KNO3 NaNO3 Ca(NO3)2 |
| Силікагель | SiO2 |
| Сіль Мора | FeSO4∙ (NH4)2SO4∙ 6H2O |
| Сода: бікарбонат кальцинована (безводна) каустична кристалічна питна | NaHCO3 Na2CO3 NaOH Na2CO3∙ 10H2O NaHCO3 |
| Суперфосфат: подвійний простий | Ca(H2PO4)2∙ H2O Ca(H2PO4)2∙ H2O + [CaSO4∙ 2H2O] |
| Сухий лід | CO2 (твердий) |
| Тальк | 3MgO∙ 4SiO2∙ H2O |
| Турнбулева синь | Fe3[Fe(CN)6]2 |
| Хромова суміш | Розчин K2Cr2O7 в концентрованій H2SO4 |
| Царська вода (водка) | Суміш концентрованих кислот: 1 об’єм HNO3 з 3 об’ємами HCl |
| Цинкова обманка | ZnS |
| Чадний газ | CO |
Хімія [Текст]: методичні вказівки до виконання лабораторних робіт для студентів напряму підготовки 6.050502 «Інженерна механіка» / уклад. І.А. Мороз, О.Є. Сколоздра. – Луцьк: Луцький НТУ, 2014. – 136 с.
Комп’ютерний набір І.А. Мороз
Редактор І.А. Мороз
Підп. до друку 2014р.
Формат 60х84/16. Папір офс. Гарнітура Таймс.
Ум. друк. арк. 8, 5. Обл.-вид. арк. 7, 0.
Тираж 100 прим. Зам. 250.
Редакційно-видавничий відділ
Луцького національного технічного університету
43018 м. Луцьк, вул. Львівська, 75
 Друк – РВВ Луцького НТУ
Друк – РВВ Луцького НТУ
|
|
