
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Приклад завдання
|
|
1. Зобразити схему гальванічного елемента, що складаєтьсязі срібних електродів, а концентрації солі срібла біля електродів відповідно рівні  і
і  . Вказати анод, катод; записати процеси на електродах; розрахувати ЕРС елемента.
. Вказати анод, катод; записати процеси на електродах; розрахувати ЕРС елемента.
2. Записати процеси, що йдуть при електролізі водного розчину 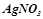 на графітових електродах. На скільки збільшиться маса катода, якщо сила струму 2А, час - 38 хв?
на графітових електродах. На скільки збільшиться маса катода, якщо сила струму 2А, час - 38 хв?
3. Записати рівняння процесів, що йдуть при корозії заліза, що має мідні включення, у вологій атмосфері ( ,
, 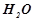 ).
).
4. Які з металів будуть розчинятися у розбавленій хлоридній кислоті:  ,
,  ,
,  ,
,  ? Написати рівняння реакцій.
? Написати рівняння реакцій.
5. Урівняти рівняння методом електронного балансу, вказати окисник, відновник, процеси окислення, відновлення:
а)  ;
;
б) 
6. Записати реакцію хлорування етану.
7. Записати схему утворення поліетилену. Вказати мономер, полімер, тип реакції утворення полімера.
8. Записати графічні формули речовин: гліцерин, диетиловий ефір, нітрометан.
ПЕРЕЛІК ПИТАНЬ, ВКЛЮЧЕНИХ ДО ЕКЗАМЕНАЦІЙНИХ БІЛЕТІВ
1. Хімія як розділ природознавства. Значення хімії у науково-технічному прогресі.
2. Основні поняття хімії: хімічний елемент, проста речовина, атом, молекула, моль, атомна і молекулярна маса.
3. Основні закони хімії: збереження маси та енергії, постійності складу, еквівалентів.
4. Хімічний еквівалент, еквівалентна маса, еквівалентний об’єм. Визначення еквівалентної маси елементів і сполук.
5. Молярна маса, Молярний об’єм. Закон Авогадро. Рівняння Менделєєва-Клапейрона.
6. Основні класи неорганічних сполук. Класифікація, номенклатура, одержання і властивості.
7. Будова атома. Роботи Резерфорда. Постулати Бора. Двоїста природа електрона.
8. Характеристика стану електронів в атомі системою квантових чисел. Головне, орбітальне, магнітне і спінове квантове число, їх фізичний зміст.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
9. Будова електронних оболонок. Принцип Паулі. Правила Клечковського та Гунда.
10. Періодичний закон Д.І. Менделєєва.
11. Періодична система Д.І.Менделєєва. Періодична зміна властивостей елементів відповідно до зміни електронної будови атомів.
12. Типи хімічного зв’язку.
13. Перший закон термодинаміки. Термохімія. Екзотермічні і ендотермічні реакції.
14. Термохімічні рівняння. Закон Гесса і наслідки з нього.
15. Поняття ентропії. Зміна ентропії при хімічних процесах і фазових перетвореннях.
16. Вільна енергія Гіббса і умови самовільного перебігу хімічних реакцій.
17. Швидкість хімічних реакцій. Фактори, що впливають на швидкість. Закон діючих мас. Константа швидкості..
18. Залежність швидкості реакцій від температури. Правило Вант-Гоффа. Рівняння Арреніуса.
19. Енергія активації. Енергетична діаграма реакції.
20. Гомогенний та гетерогенний каталіз.
21. Оборотні та необоротні хімічні реакції. Хімічна рівновага. Константа рівноваги.
22. Зміщення хімічної рівноваги. Принцип Ле-Шательє.
23. Дисперсні системи та їх класифікація.
24. Істинні розчини. Фізичні та хімічні процеси при розчиненні.
25. Розчинність. Способи вираження концентрації розчинів.
26. Вода як найпоширеніший розчинник. Діаграма стану води.
27. Жорсткість води і способи усунення солей жорсткості.
28. Властивості розчинів неелектролітів. Закони Рауля.
29. Осмос. Осмотичний тиск.
30. Відхилення від законів Рауля для електролітів. Ізотонічний коефіцієнт.
31. Механізм електролітичної дисоціації. Фактори, що впливають на ступінь електролітичної дисоціації. Сильні та слабкі електроліти.
32. Константа дисоціації. Закон розбавлення Оствальда.
33. Іонний добуток води. Водневий показник. Індикатори.
34. Гідроліз солей. Фактори, що впливають на ступінь гідролізу.
35. Ступінь окиснення. Правила визначення ступеня окиснення.
36. Окисно-відновні реакції. Складання ОВР. Підбір коефіцієнтів методом електронного балансу. Найважливіші окислювачі і відновники.
37. Гальванічні елементи. Анод і катод. Процеси, що відбуваються на електродах. ЕРС гальванічного елемента.
38. Електродний потенціал. Залежність електродного потенціалу від різних факторів. Рівняння Нернста.
39. Акумулятори. Процеси, що відбуваються при зарядці та роботі свинцевого акумулятора.
40. Хімічні джерела електричної енергії. Найважливіші гальванічні елементи.
41. Електроліз розплавів і розчинів. Процеси анодного окислення і катодного відновлення. Послідовність розрядки катіонів на катоді.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
42. Закони електролізу. Використання електролізу в техніці.
43. Загальні властивості металів. Кристалічна будова металів.
44. Місце металів у Періодичній системі. Ряд напруг металів.
45. Хімічні властивості металів. Взаємодія металів з водою та кислотами.
46. Хімічні властивості металів. Взаємодія металів з лугами та розчинами солей.
47. Корозія металів. Види корозії. Класифікація корозійних процесів. Шкода, якої завдає корозія народному господарству.
48. Механізм електрохімічної корозії. Типи процесів деполяризації на катоді. Утворення іржі. Види електрохімічної корозії.
49. Методи захисту металів від хімічної і електрохімічної корозії.
50. Основні положення теорії будови органічних сполук О.Бутлерова.
51. Основні класи органічних сполук. Функціональні групи.
52. Алкани. Номенклатура, основні хімічні властивості. Використання в народному господарстві.
53. Алкени. Номенклатура, основні хімічні властивості.
54. Дієнові вуглеводні. Поняття про каучуки. Вулканізація.
55. Високомолекулярні сполуки. Реакції полімеризації і поліконденсації.
56. Термопластичні і термореактивні смоли. Конструкційні пластмаси.
|
|
