
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Способи добування солей
|
|
1. Реакція нейтралізації:
КОН + HNО3 = KNО3 + Н2О.
2. Взаємодія кислот з основними оксидами:
CuO + H2SО4 = CuSO4 + Н2О.
3. Взаємодія кислот із солями:
ВаСl2 + H2SО4 = BaSО4↓ + 2НСl.
4. Взаємодія кислот з металами:
Mg + 2HCl = MgCl2 + H2↑.
5. Взаємодія двох різних солей:
AgNО3 + КСl = AgCl↓ + KNО3.
6. Взаємодія солей з металами:
Fe + CuSO4 = FeSО4 + Cu.
7. Взаємодія солей з лугами:
ЗКОН + FeCl3 = Fe(OH)3↓ + ЗКСl.
8. Взаємодія лугів з кислотними оксидами:
Са(ОН)2 + СО2 = СаСО3 + Н2О.
9. Взаємодія основних оксидів з кислотними:
СаО + SiО2 = CaSiО3.
10. Взаємодія металів із неметалами:
Fe + S = FeS.
Із речовин одного класу можна добути речовини іншого класу. Такий зв’язок між класами неорганічних сполук називають генетичним. Розглянемо його більш детально. Із простих речовин можна одержати складну речовину, наприклад:
2Ca + O2 = 2CaO.
Із складної речовини можна одержати прості речовини, наприклад:
2H2O 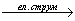 2H2 + O2.
2H2 + O2.
Із металу реакцією горіння можна одержати основний оксид, який з водою утворить основу. При дії на основу кислотою реакцією нейтралізації можна одержати сіль. Розглянемо такий генетичний зв’язок на прикладі металу барію. Складемо схему:
Ba 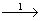 BaO
BaO 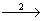 Ba(OH)2
Ba(OH)2 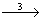 Ba3(PO4)2.
Ba3(PO4)2.
Складемо рівняння хімічних реакцій, за допомогою яких можна здійснити такі перетворення:
1) 2Ba + O2 = 2BaO;
2) BaO + H2O = Ba(OH)2;
3) 3Ba(OH)2 + 2H3PO4 = Ba3(PO4)2 + 6H2O.
Із неметалу реакцією горіння можна одержати кислотний оксид, який з водою утворить кислоту. Під час дії на кислоту лугом можна одержати сіль. Розглянемо такий генетичний зв’язок на прикладі неметалу фосфору. Складемо схему:
P 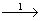 P2O5
P2O5 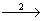 H3PO4
H3PO4 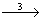 Ba3(PO4)2.
Ba3(PO4)2.
Складемо рівняння хімічних реакцій, за допомогою яких можна здійснити такі перетворення:
1) 4P + 5O2 = 2P2O5;
2) P2O5 + 3H2O = 2H3PO4;
3) 2H3PO4 + 3Ba(OH)2 = Ba3(PO4)2 + 6H2O.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Наведені вище схеми генетичних зв’язків можна представити в загальному вигляді такою схемою:
| метал → основний оксид → основа → | сіль; |
| | | |
| неметал → кислотний оксид → | кислота. |
ЗАДАЧІ ТА ВПРАВИ
1. Скласти рівняння реакцій, за допомогою яких можна здійснити такий цикл перетворень, згрупувати речовини у відповідні класи сполук:
1. 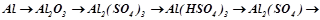
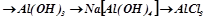
2. P → P2O5 → H3PO4 → Ca(H2PO4)2 → CaHPO4 → Ca3(PO4)2 → CaHPO4
3. FeCl3 ® Fe(OH)3 ® Fe2O3 ® Fe(NO3)3 ® Fe(OH)2NO3 ® Fe(OH)3 ® Fe(HSO4)3 ® Fe2(SO4)3
4. Cu ® CuSO4 ® Cu ® Cu(NO3)2 ® Cu(OH)2 ® CuOHCl ® CuCl2 ® Cu3(PO4)2 ® Cu(H2PO4)2
5. SO2 ® SO3 ® H2SO4 ® SO2 ® K2SO3 ® KHSO3 ® SO2 ® CaSO3 ® Ca(HSO3)2 ® CaCl2 ® Ca(OH)2 ® CaCO3 ® CaO
6. Al(NO3)3 ® Al(OH)3 ® Al2O3 ® Al2(SO4)3 ® Al(HSO4)3 ® Al2(SO4)3 ® Al(OH)SO4 ® Al(OH)3 ® Na[Al(OH)4] ® AlCl3
7. NaOH ® Na2CO3 ® NaHCO3 ® Na2CO3 ® CaCO3 ® CO2 ® CaCO3 ® Ca(NO3)2 ® Ca(NO2)2
8. P2O5 ® HPO3 ® H3PO4 ® Ca(H2PO4)2 ® CaHPO4 ® Ca3(PO4)2
9. Be ® BeO ® BeSO4 ® Be(HSO4)2 ® BeSO4 ® Be(OH)2 ® Be(OH)NO3 ® Be(NO3)2 ® BeOН ® K2BeO2
10. Sn ® SnCl2 ® Sn(NO3)2 ® Sn(OH)NO3 ® Sn(OH)2 ® Na2SnO2 ® SnSO4 ® SnS ® SO2.
11. Zn ® Zn(NO3)2 ® ZnSO4 ® Zn(HSO4)2 ® ZnSO4 ® (ZnOH)2SO4 ® Zn(OH)2 ® Na2[Zn(OH)4] ® ZnCl2.
12. КOH ® КHCO3 ® К2CO3 ® ВаCO3 ® CO2 ® CaCO3 ® СаСІ2→ Ca(NO3)2 ® Ca(NO2)2.
13. Al(OH)3 ® Al(OH)2Cl ® AlOHCl2 ® AlCl3 ® Al(OH)3 ® NaAlO2
14. K ® KOH ® KHCO3 ® K2CO3 ® CO2 ® CaCO3 ® Ca(HCO3)2
ЛІТЕРАТУРА: [2 – c. 219-227; 3 – с. 173-216; 4 – с. 140-154].
ЗАНЯТТЯ № 8
Тема: ХІМІЧНИЙ ЗВ’ЯЗОК ТА ВЛАСТИВОСТІ РЕЧОВИНИ
Мета заняття: вивчити основні типи хімічного зв’язку і на цій основі вміти встановлювати кореляцію між типом хімічного зв’язку в речовинах та хімічними, фізико-хімічними і фізичними властивостями цих речовин
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Ковалентний зв’язок (види, характеристика, приклади), механізми його утворення (обмінний і донорно-акцепторний).
2. Йонний зв’язок та його характеристики
3. Металевий зв’язок та його особливості.
4. Міжмолекулярні зв’язки.
5. Хімічний зв’язок в твердих речовинах.
ТЕОРЕТИЧНІ ВІДОМОСТІ
ТИПИ ХІМІЧНОГО ЗВ’ЯЗКУ
Розрізняють п’ять основних типів зв’язку (рис.2): ковалентний, йонний, металевий, водневий і ван-дер-ваальсовий. Основним типом внутрішньомолекулярного хімічного зв’язку є ковалентний.
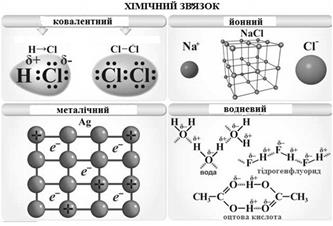
Рис. 2. Типи хімічних зв’язків.
Ковалентний зв’язок – хімічний зв’язок між двома атомами, який здійснюється спільною парою електронів, що утворюється внаслідок перекриванням електронних орбіталей взаємодіючих атомів.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Залежно від природи атомів, які взаємодіють між собою, спільна електронна пара може однаково належати атомам, що взаємодіють між собою або зміщуватись в той чи інший бік. Для оцінки здатності атома даного елемента, що утворює зв’язок, зміщувати електрону густину, користуються значенням відносної електронегативності (ЕН). Чим більше ЕН атома, тим сильніше притягує він узагальнені електрони. Причому, спільна електронна пара зміщується до атома з більшою ЕН в тим більшій мірі, чим більшою є різниця електронегативності (Δ ЕН) атомів, що взаємодіють. В результаті несиметричного розподілу електронної густини між атомами з різною ЕН зв’язок стає полярним. З ростом Δ ЕН ступінь ковалентності зв’язку зменшується і зростає ступінь йонності зв’язку. Значення ЕН атомів деяких елементів наведені в таблиці 4.
Ковалентний зв’язок – це міцний хімічний зв’язок, він може об’єднувати атоми не лише в молекули, але і в кристали.
Найважливішими характеристиками ковалентного зв’язку є: насичуваність (здатність елементів утворювати певну кількість зв’язків); напрямленість (просторова напрямленість); поляризованість (здатність зв’язку перетворюватись на полярний (або більш полярний) під впливом зовнішнього електростатичного поля).
Таблиця 4
Відносна електронегативність атомів
| H | ||||||
| 2, 2 | ||||||
| Li | Be | B | C | N | O | F |
| 1, 0 | 1, 5 | 2, 0 | 2, 5 | 3, 0 | 3, 5 | 4, 0 |
| Na | Mg | Al | Si | P | S | Cl |
| 0, 9 | 1, 2 | 1, 5 | 1, 8 | 2, 1 | 2, 5 | 3, 0 |
| K | Сa | Ga | Ge | As | Se | Br |
| 0, 8 | 1, 0 | 1, 6 | 2, 0 | 2, 0 | 2, 4 | 2, 9 |
| Rb | Sr | In | Sn | Sb | Te | I |
| 0, 8 | 1, 0 | 1, 7 | 1, 8 | 1, 9 | 2, 1 | 2, 5 |
Йонний зв’язок – міцний хімічний зв’язок, що утворюється між атомами з великою різницею електронегативності (Δ ЕН > 1, 7 за Полінгом) в результаті зміщення електронної густини до найбільш електронегативного атома. Між йонами, що утворилися, виникає електростатичне притягання, яке називається й онним зв’язком (рис. 2).
Повного 100% зміщення електронної густини до атома з більшою ЕН не відбувається навіть в найбільш йонних сполуках, якими є бінарні сполуки лужних металів з галогенами. Це пояснюється, зокрема, впливом зарядів йонів, що утворилися, на електронні оболонки один одного, тобто їх взаємною поляризацією. Прикладом може бути сполука CsF, в якій за Δ ЕН = 3, 3 " ступінь йонності" складає 97%.
На відміну від ковалентного зв’язку, характеристиками йонного зв’язку є ненапрямленість і ненасичуваність. А характеристикою сполук йонного типу є добра розчинність в полярних розчинниках (вода, кислоти і т. д.).
Металевий зв’язок (рис.2). Відмінною характеристикою атомів металів є те, що число валентних електронів менше ніж число валентних орбіталей. У вузлах кристалічних ґраток металів знаходяться позитивні йони, а в міжвузлях – валентні електрони (" електронний газ"), які здійснюють зв’язок між йонами і легко пересуваються усередині кристалу. Навіть невелике збудження призводить до міграції електронів. Цим пояснюється висока тепло- і електропровідність металів.
Ван-дер-ваальсовий зв’язок – це найбільш універсальний вид міжмолекулярної взаємодії. Він відноситься до зв’язку невалентного типу, що виникає без передачі атомами електронів.
Міжмолекулярні взаємодії здійснюються за допомогою кулонівських сил взаємодії між електронами і ядрами однієї молекули і ядрами і електронами іншої.
Розрізняють такі види сил міжмолекулярної взаємодії: орієнтаційні (диполь-дипольна між полярними молекулами), індукційні, або поляризаційні (дія полярної молекули на неполярну) і дисперсійні (проявляються під час взаємодії будь-яких атомів і молекул в результаті виникнення миттєвих мікродиполів, індукованих рухом електронів і коливанням ядер). Міжмолекулярна взаємодія не призводить до розриву або утворення нових хімічних зв’язків валентного типу. Вона зумовлює перетворення речовини із газоподібного стану в рідкий і далі в твердий.
Водневий зв’язок (Н-зв’язок) є важливим типом міжмолекулярних взаємодій. Цей зв’язок виникає між молекулами, в яких атом Гідрогену зв’язаний з атомами, що мають велику електронегативність і малий радіус (F, O, N). Між такими молекулами виникають додаткові хімічні зв’язки невалентного типу, що називаються водневими. Здійснюються такі зв’язки за рахунок сил електростатичного притягання, але певний внесок має і донорно-акцепторна взаємодія, що визначає просторову напрямленість водневих зв’язків. Чим більшою є ЕН елемента-партнера і меншим його розмір, тим міцнішим є водневий зв’язок. Н-зв’язок є на порядок слабкішим за ковалентний і тому легко руйнується. Схематично водневий зв’язок представлений на рисунку 2.
У сполуках з водневими зв’язками утворюються асоціати, що призводить до зміни фізичних властивостей речовин: підвищуються теплоти випаровування, температури кипіння і плавлення.
Водневий зв’язок може бути як міжмолекулярним, так і внутрішньомолекулярним (рис. 2), переважно в молекулах органічних сполук.
ХІМІЧНИЙ ЗВ’ЯЗОК В ТВЕРДИХ РЕЧОВИНАХ.
Властивості твердих речовин визначаються природою частинок, що знаходяться у вузлах кристалічної ґратки, їх розташуванням і типом зв’язків, між цими частинками (табл.5).
Таблиця 5
Класифікація кристалів за типом хімічного зв’язку
| Тип кристалу | Структурні частинки | Сили між частинками | Властивості | Приклади |
| Атомний | Атоми | Ван-дер-ваальсова (дисперсійна) взаємодія | М’якість, низька температура плавлення, погані тепло-, та електропровідність | Благородні гази – Аr, Kr, та ін. |
| Молекулярний | Полярні або неполярні молекули | Ван-дер-ваальсові та водневі зв’язки | Помірна м’якість, температура плавлення від низької до помірно високої, погані тепло- і електропровідність | H2, N2, СН4, цукор, СО2 |
| Йонний | Позитивно і негативно заряджені йони | Йонний зв’язок | Твердість і крихкість, висока температура плавлення, погані тепло- і електропровідність | Типові солі: NaCl, Ca(NО3)2 та ін |
| Ковалентний | Атоми | Ковалентний зв’язок | Висока твердість, дуже висока температура плавлення, погані тепло- і електро-провідність | Алмаз, BN, кварц SiО2, карбіди, силіциди |
| Металевий | Катіони металів у вузлах кристалічн. ґраток | Металічний і ковалентний зв’язок | Ступінь твердості – різна, температура пл. від низької до дуже високої, високі тепло- і електропровідність, ковкість, блиск, пластичність | Усі метали (Fe, Al, Pb, Cu та |
ОСНОВНІ ХАРАКТЕРИСТИКИ ХІМІЧНОГО ЗВЯЗКУ
Хімічний зв’язок в молекулах зумовлений перекриванням валентних орбіталей взаємодіючих атомів і супроводжується зменшенням повної енергії системи. Залежно від способу перекривання і симетрії орбіталі, що утворюється, розрізняють σ - та π -зв’язки.
σ -Зв’язок (сигма-зв’язок) утворюється в результаті перекривання електронних орбіталей уздовж лінії, що з’єднує центри атомів. У випадку σ -зв’язку відбувається максимальне перекривання орбіталей і тому, саме σ -зв’язок відповідає за геометрію молекули.
Між двома атомами можливий тільки однин σ -зв’язок.
π -Зв’язок (пі-зв’язок) виникає в результаті перекривання атомних орбіталей вздовж ліній, перпендикулярних тій, що з’єднує центри атомів (тобто ділянка перекривання знаходиться над і під лінією, що з’єднує центри атомів):
В результаті додаткового перекривання атомних орбіталей за рахунок π -зв’язку між атомами виникають кратні зв’язки: одинарний (F – F); подвійний (O=O); потрійний (N≡ N).
Хімічний ковалентний зв’язок характеризується довжиною, валентним кутом і енергією.
Довжина зв’язку – відстань між ядрами атомів, що утворюють сполуку. Довжини зв’язків зазвичай знаходяться в межах від 0, 1 до 0, 27 нм (Н2 – 0, 075; N2 – 0, 110; О2 – 0, 121, I2 – 0, 267). Зміна довжин зв’язків в схожих сполуках пов’язана зі зміною ефективних радіусів елементів, що входять в ці сполуки, наприклад, для HF, HCl, HBr і HI довжини зв’язків змінюються відповідно: 0, 100; 0, 127; 0, 141; 0, 162 нм.
Валентний кут – кут між уявними лініями, що з’єднують центри атомів у напрямі дії хімічного зв’язку:
Валентні кути, як і довжини зв’язків, експериментально визначають з високою точністю.
Характеристикою міцності хімічного зв’язку є енергія зв’язку Езв – енергія, яка необхідна для розриву (дисоціації) зв’язків в молекулі з одержанням нейтральних атомів. Вимірюється в електронвольтах (еВ) для одного зв’язку або в кДж/моль для одного моля зв’язків. Так, енергія зв’язку Н-Н в молекулі Н2 рівна 435 кДж/моль, а середня енергія одного зв’язку С-Н у багатоатомній молекулі СН4 рівна Едисс (СН4 /4) = 1648/4 = 412 кДж/моль.
ЗАДАЧІ ТА ВПРАВИ
1. Визначити тип хімічного зв’язку у наступних сполуках: СO2, BF3, NH3, SrBr2, Cl2, Ca3(PO4)2, НClO.
2. До якого з елементів зміщені спільні електронні пари в кожній з наведених сполук: Cl2O7, CO2, NH3, SiF4, OF2, B2O3. Вкажіть сумарне число електронів, що утворюють зв’язки в цих речовинах.
3. Поясніть механізм утворення а) алюміній хлориду; б) силіций тетрахлориду; в) калій фториду; г) цезій хлориду. вкажіть тип хімічного зв’язку в кожній з цих молекул.
4. В якій з наведених сполук зв’язок елемент – хлор має йонну природу: CCl4, Cl2O, MgCl2, HCl, ICl7, CsCl. Відповідь обгрунтуйте.
5. Користуючись даними таблиці відносних електронегативностей, обчисліть, який з наведених зв’язків є найбільш полярним: а) Сa – H; б) Si – H; в) S – H; г) N – H; д) I – H.
6. Скільки спільних електронних пар утворюють зв’язки в таких сполуках: а) бор нітрид; б) ксенон тетрафторид; в) сульфур (IV) оксид; г) фосфін.
7. Запишіть графічні формули фосфор (V) оксиду та ортофосфатної кислоти. Вкажіть кількість зв’язків між атомами Фосфору та Оксигену.
ЛІТЕРАТУРА: [ 2 – c. 219-227; 3 – c. 173-216].
ЗАНЯТТЯ № 9
Тема: ЕНЕРГЕТИКА ХІМІЧНИХ ПРОЦЕСІВ І ХІМІЧНА СПОРІДНЕНІСТЬ
Мета заняття: вивчити основні термодинамічні функції стану та закони термохімії. Навчитись розв’язувати розрахункові задачі з термохімії і термодинаміки і визначати напрям перебігу хімічних реакцій.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Що називається ентальпією утворення хімічної сполуки?
2. Екзотермічні, ендотермічні реакції.
3. Дати визначення закону Гесса. Наслідок з закону Гесса.
4. Ентропія, вільна енергія Гіббса. Напрям хімічної реакції.
ТЕОРЕТИЧНІ ВІДОМОСТІ
Енергетичний стан системи при хімічних, фазових та структурних перетвореннях і хімічна спорідненість оцінюється трьома основними термодинамічними функціями: ентальпія (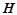 ), ентропія (
), ентропія (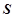 ) та ізобаро-ізотермічний потенціал (
) та ізобаро-ізотермічний потенціал (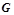 ).
).
Ці термодинамічні функції є функціями стану, тобто залежать лише від початкового і кінцевого станів системи і не залежать від шляху перебігу процесу.
1. Енергетика хімічних процесів
Під час хімічних реакцій рвуться зв’язки між атомами у молекулах вихідних речовин і виникають нові зв’язки у молекулах продуктів реакції. Ці зміни супроводжуються виділенням або поглинанням енергії. Як правило, це енергія теплова.
Величина теплової енергії 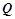 що виділяється чи поглинається під час хімічних реакцій – тепловий ефект хімічної реакції. Реакції, що відбуваються з виділенням тепла – екзотермічні.
що виділяється чи поглинається під час хімічних реакцій – тепловий ефект хімічної реакції. Реакції, що відбуваються з виділенням тепла – екзотермічні.
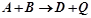 .
.
Реакції, що відбуваються з поглинанням тепла – ендотермічні.
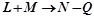 .
.
Розділ термодинаміки, що вивчає енергетичні ефекти хімічних реакцій, називається термохімією.
При постійних температурі і тиску тепловий ефект хімічної реакції виражається зміною ентальпії (Δ Hх.р., кДж). Для екзотермічної реакції Δ Hх.р< 0, для ендотермічної реакції Δ Hх.р > 0.
Якщо умови проведення реакції стандартні – температура 298 К (25 оС), тиск 101, 325 кПа (1 атм), то зміну ентальпії називають стандартною (Δ H0х.р.).
Тепловий ефект реакції утворення 1 моля хімічної сполуки з елементів називається ентальпією утворення сполуки (Δ H0утв., кДж/моль). Стандартна ентальпія утворення є мірою термодинамічної стійкості сполуки, кількісним вираженням енерговмісту речовини. Більш стійкою за стандартних умов є та речовина, що має менше алгебраїчне значення Δ H0утв.. Ентальпії утворення простих речовин (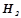 ;
; 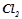 ;
; 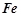 ) в їх стійкому стані прийнято рівними нулю. Значення стандартних ентальпій утворення деяких сполук подані у додатку 1.
) в їх стійкому стані прийнято рівними нулю. Значення стандартних ентальпій утворення деяких сполук подані у додатку 1.
Тепловий ефект реакції розкладу сполуки на елементи називається ентальпією розкладу сполуки (Δ Н0розкладу).
Перший закон термохімії (Лавуазьє, Лаплас, 1780-1784 рр.) – зміна ентальпії прямої хімічної реакції рівна за абсолютним значенням і протилежна за знаком зміні ентальпії зворотної реакції. Зокрема при розкладі сполуки на прості речовини відбувається зміна ентальпії, рівна за модулем, але протилежна за знаком зміні ентальпії при утворенні цієї сполуки з тих же простих речовин:
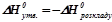 .
.
Другий закон термохімії (закон Гесса). Ентальпія – функція стану системи. Тому тепловий ефект хімічної реакції Δ Hх.р. залежить лише від природи і фізичного стану реагуючих речовин і продуктів реакції і не залежить від шляху її проведення.
При термохімічних розрахунках використовують
наслідок з закону Гесса:
Тепловий ефект хімічної реакції рівний різниці між сумою ентальпій утворення продуктів реакції і сумою ентальпій утворення реагуючих речовин з урахуванням їх коефіцієнтів у рівнянні реакції:
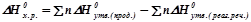 ,
,
де 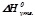 – стандартні ентальпії утворення продуктів і реагуючих речовин (додаток 1).
– стандартні ентальпії утворення продуктів і реагуючих речовин (додаток 1).
Рівняння хімічної реакції, в якому вказані агрегатні стани
реагуючих речовин (т – твердий, р – рідкий, г – газоподібний) і величина її теплового ефекту, називається термохімічним рівнянням:
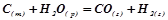 ;
; 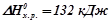 .
.
2. Хімічна спорідненість (напрям хімічних реакцій)
Під час реакцій або фазових перетворень система може переходити у більш впорядкований або у менш впорядкований стан.
Ентропія 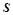 , Дж/К∙ моль – це термодинамічна функція, що є кількісною мірою невпорядкованості системи, хаотичності руху частинок, з яких вона складається.
, Дж/К∙ моль – це термодинамічна функція, що є кількісною мірою невпорядкованості системи, хаотичності руху частинок, з яких вона складається.
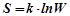 ,
,
де 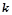 – стала Больцмана,
– стала Больцмана, 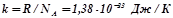 ;
;
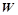 – термодинамічна ймовірність, число мікростанів, якими може бути здійснено даний макростан системи.
– термодинамічна ймовірність, число мікростанів, якими може бути здійснено даний макростан системи.
Зміна ентропії реакції Δ S0х.р . обчислюється як різниця між сумою ентропій утворення продуктів та сумою ентропій утворення реагентів:
 ,
,
де 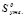 – стандартні ентропії утворення продуктів і реагуючих речовин, Дж/моль·К (додаток 1).
– стандартні ентропії утворення продуктів і реагуючих речовин, Дж/моль·К (додаток 1).
Ентропія зростає із збільшенням інтенсивності руху частинок і ступеня безладності в системі: при нагріванні, плавленні, випаровуванні, збільшенні числа моль газоподібних речовин, у процесах хімічного розкладу. Для таких процесів Δ S0 > 0.
Процеси, пов’язані із впорядкуванням системи, наприклад, процеси конденсації, кристалізації, стиснення, полімеризації, переходу до більш впорядкованої кристалічної структури, синтезу – ведуть до зменшення ентропії, Δ S0 < 0.
Рушійною силою хімічної реакції у ізобарно-ізотермічному процесі є вільна енергія Гіббса (ізобаро-ізотермічний потенціал) 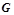 , кДж/моль, яка залежить від природи речовин, їх кількості і від температури.
, кДж/моль, яка залежить від природи речовин, їх кількості і від температури.
Самовільно можуть проходити лише процеси, які супроводяться зменшенням вільної енергії Гіббса, при цьому 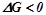 . Отже, енергія Гіббса – це міра хімічної спорідненості.
. Отже, енергія Гіббса – це міра хімічної спорідненості.
Зміна вільної енергії Гіббса визначається двома факторами: енергетичним (Δ Hх.р.) і термодинамічним (ентропійним) (T·Δ S0х.р.):
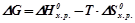 .
.
Для стандартних умов зміну енергії Гіббса хімічного процесу можна визначити як різницю між сумою вільних енергій продуктів реакції та реагуючих речовин:
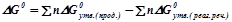 ,
,
де 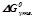 – стандартні енергії Гіббса утворення продуктів і реагуючих речовин, кДж/моль (додаток 1).
– стандартні енергії Гіббса утворення продуктів і реагуючих речовин, кДж/моль (додаток 1).
Характер зміни енергії Гіббса дає можливість зробити висновки про термодинамічну ймовірність перебігу оборотньої реакції:
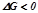 – відбувається пряма реакція;
– відбувається пряма реакція;
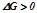 – відбувається зворотна реакція;
– відбувається зворотна реакція;
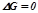 – ознака стану термодинамічної рівноваги.
– ознака стану термодинамічної рівноваги.
Відповідно температура, при якій система перебуває в рівновазі (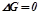 ) визначиться з відношення:
) визначиться з відношення:
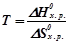 .
.
Ця температура вважається температурою початку реакції.
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
Приклад 1. Визначити тепловий ефект хімічної реакції 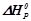 горіння метану:
горіння метану:
 .
.
Розв’язок: Тепловий ефект хімічної реакції, тобто стандартну зміну ентальпії реакції 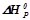 визначаємо, використовуючи наслідок з закону Гесса: тепловий ефект хімічної реакції рівний різниці сум ентальпій утворення продуктів реакції і сум ентальпій утворення вихідних речовин.
визначаємо, використовуючи наслідок з закону Гесса: тепловий ефект хімічної реакції рівний різниці сум ентальпій утворення продуктів реакції і сум ентальпій утворення вихідних речовин.
При додаванні ентальпію утворення кожної речовини необхідно помножити на стехіометричний коефіцієнт, що стоїть перед цією речовиною в рівнянні хімічної реакції.
Ентальпії утворення простих речовин дорівнюють нулю.
Виписуємо з таблиці (додаток 1) значення ентальпій утворення речовин, що приймають участь в реакції горіння:
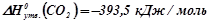 ;
;
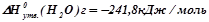 ;
;
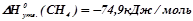 ;
;
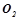 – проста речовина. Ентальпія утворення її дорівнює нулю.
– проста речовина. Ентальпія утворення її дорівнює нулю.
Записуємо математичний вираз наслідку з закону Гесса:
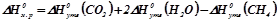
Використовуючи числові значення, знайдемо:
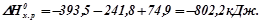
Приклад 2. Знайти об¢ єм ацетилену (н.у.) при повному згоранні якого виділяється теплота, достатня для нагрівання 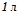 води від
води від 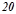 до
до 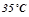 . Масову теплоємність води прийняти рівною
. Масову теплоємність води прийняти рівною 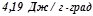 .
.
Розв’язок: Реакція горіння ацетилену:
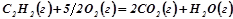
Знаходимо тепловий ефект хімічної реакції за наслідком з закону Гесса:

Ця кількість теплоти виділяється при згоранні 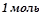 , ацетилену, тобто
, ацетилену, тобто 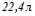 (н.у.). Визначимо, скільки тепла потрібно для нагрівання 1 л. води:
(н.у.). Визначимо, скільки тепла потрібно для нагрівання 1 л. води:
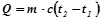 ,
,
де 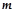 – маса води (
– маса води (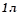
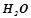 має масу
має масу 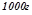 );
);
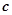 – масова теплоємність води;
– масова теплоємність води;
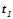 – початкова температура води;
– початкова температура води;
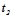 – кінцева температура води.
– кінцева температура води.
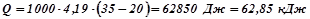 .
.
Визначаємо потрібний об’єм ацетилену. Складаємо пропорцію за умови, що все тепло, що виділяється, іде на нагрівання води:
при згоранні 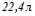
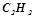 виділяється
виділяється 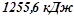 тепла;
тепла;
при згоранні хл 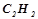 виділиться
виділиться 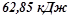 тепла:
тепла:
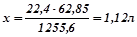 .
.
Відповідь: 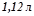
 (н.у.).
(н.у.).
Приклад 3. Використовуючи довідникові дані, (додаток 1) встановити, чи можливе при температурах 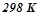 і
і 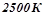 відновлення титан (IV) оксиду до вільного металу за реакцією:
відновлення титан (IV) оксиду до вільного металу за реакцією:
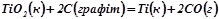 .
.
Залежністю 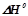 і
і 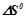 від температури знехтувати.
від температури знехтувати.
Розв’язок: В таблиці знаходимо значення 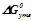 при
при 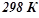 для
для 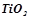 (
(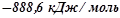 ) і
) і 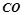 (
(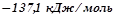 ). Тоді для даної реакції при
). Тоді для даної реакції при 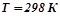 :
:
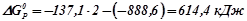 .
.
Отже, відновлення 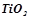 при
при 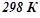 неможливе тому, що
неможливе тому, що 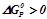 .
.
Для обчислення 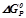 при
при 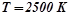 використовуємо рівняння:
використовуємо рівняння: 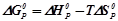 .
.
Для розрахунку 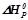 і
і 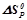 необхідно взяти з таблиці значення ентальпій і ентропій утворення для учасників реакції:
необхідно взяти з таблиці значення ентальпій і ентропій утворення для учасників реакції:
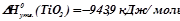 ;
;
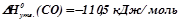 ;
;
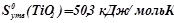 ;
;
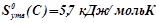 ;
;
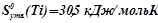 ;
;
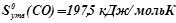 ;
;
Використовуючи наслідок з закону Гесса, знаходимо для даної реакції:
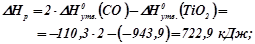
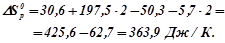
Знаходимо 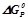 , виражаючи
, виражаючи 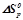 в
в 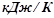 .
.
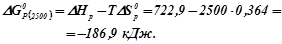
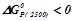 , відновлення
, відновлення 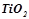 графітом при
графітом при 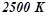 можливе.
можливе.
ЗАДАЧІ ТА ВПРАВИ
1. При сполученні 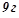
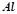 з киснем виділяється
з киснем виділяється  тепла. Визначити ентальпію утворення алюміній оксиду.
тепла. Визначити ентальпію утворення алюміній оксиду.
2. При гашенні вапна відбувається наступна реакція:
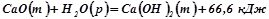 .
.
Визначити кількість тепла, що виділяється при гашенні 1 тонни вапна, яке містить 80% 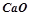 .
.
3. Реакція одержання водного газу іде за рівнянням:
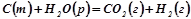 .
.
Обчислити зміну ентальпії в реакції і знайти, скільки витрачається тепла при одержанні 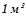 водного газу (
водного газу (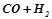 ) (н.у.)
) (н.у.)
4. На скільки градусів можна нагріти 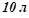 води за рахунок тепла, що виділяється при спалюванні
води за рахунок тепла, що виділяється при спалюванні 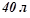 метану (н.у.). Тепловими втратами знехтувати. Масова теплоємність води дорівнює
метану (н.у.). Тепловими втратами знехтувати. Масова теплоємність води дорівнює 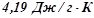 .
.
5. Не виконуючи обчислень, встановити знак 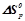 наступних процесів:
наступних процесів:
а) 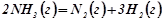 ;
;
б) 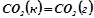 ;
;
в) 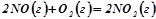 ;
;
г)  ;
;
д) 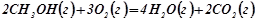 ;
;
е) конденсація насиченої водяної пари;
ж) кристалізація металу з розплаву.
6. Встановити можливість взаємодії 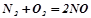 за стандартних умов. При яких температурах ця взаємодія можлива? Пояснити причини стійкості земної атмосфери.
за стандартних умов. При яких температурах ця взаємодія можлива? Пояснити причини стійкості земної атмосфери.
7. При якій температурі можливий розклад вапняку:
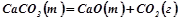 .
.
8. Шляхом обчислення 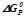 визначити можливість взаємодії вугілля і кисню при кімнатній температурі:
визначити можливість взаємодії вугілля і кисню при кімнатній температурі: 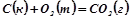 .
.
9. Які з перелічених оксидів можуть бути відновлені алюмінієм при 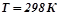 :
: 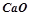 ,
, 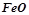 ,
,  ,
, 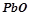 ,
, 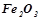 ,
, 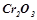 ?
?
10. Реакція горіння фосфіну виражається рівнянням:
 .
.
Обчислити ентальпію утворення 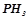 , користуючись наслідком із закону Гесса і ентальпіями утворення
, користуючись наслідком із закону Гесса і ентальпіями утворення 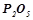 і води.
і води.
ЛІТЕРАТУРА: [1 – с. 128-151; 2 – c. 130-150;
3 – с. 119-127; 4 – с. 104-129].
ЗАНЯТТЯ № 10
Тема: ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. ХІМІЧНА РІВНОВАГА
Мета заняття: вивчити залежність швидкості хімічних реакцій від концентрації та температури, побудувати графіки залежності швидкості реакції від цих факторів. Вивчити особливості оборотних хімічних реакцій. Розглянути суть константи хімічної рівноваги та фактори, які впливають на зміщення хімічної рівноваги.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Фактори, які впливають на швидкість хімічних реакцій.
2. Закон діючих мас.
3. Константа швидкості хімічних реакцій. Від яких факторів вона залежить?
4. Залежність швидкості хімічних реакцій від температури.
5. Енергія активації. Рівняння Арреніуса.
6. Поняття про каталізатори. Гомогенний та гетерогенний каталіз.
7. Які реакції називаються оборотними?
8. Хімічна рівновага та умови її встановлення.
9. Константа хімічної рівноваги.
10. Зміщення хімічної рівноваги. Принцип Ле-Шательє.
ТЕОРЕТИЧНІ ВІДОМОСТІ
Хімічна кінетика – це область хімії, що вивчає швидкість і механізм протікання реакцій.
Гомогенними називаються реакції, що протікають у однорідному середовищі (газ чи розчин).
Гетерогенними називаються реакції, що протікають у неоднорідному середовищі між речовинами, що перебувають у різних агрегатних станах (газ і рідина; тверда речовина і рідина, газ і тверда речовина).
Гомогенні реакції відбуваються у всьому об’ємі системи, гетерогенні – лише на поверхні поділу фаз.
1. Швидкість хімічних реакцій
Для гомогенних процесів, що відбуваються без зміни об’єму, швидкість хімічної реакції визначають як зміну концентрацій реагуючих речовин або продуктів реакції за одиницю часу. Швидкістю гетерогенної реакції називають кількість речовини, що вступає в реакцію або утворюється під час реакції за одиницю часу на одиниці поверхні фаз.
Швидкість хімічних реакцій залежить від природи реагуючих речовин, їх концентрацій, температури, наявності каталізатора і деяких інших зовнішніх факторів.
Залежність швидкості реакції від концентрації
Закон діючих мас (Гульдберг і Вааге): при сталій температурі швидкість хімічних реакцій пропорційна добутку концентрацій реагуючих речовин в степенях, що є їх коефіцієнтами в рівнянні хімічної реакції.
Для гомогенної реакції: 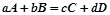 швидкість реакції:
швидкість реакції:
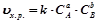 ,
,
де СA і СB – концентрації речовин А і В в моль/л;
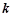 – константа швидкості хімічної реакції, залежить від температури, природи реагуючих речовин і від наявності каталізатора, але не залежить від концентрації. Константа швидкості кількісно рівна швидкості реакції, коли
– константа швидкості хімічної реакції, залежить від температури, природи реагуючих речовин і від наявності каталізатора, але не залежить від концентрації. Константа швидкості кількісно рівна швидкості реакції, коли 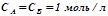 .
.
Якщо реагують гази, то концентрації можна замінити парціальними тисками газів. Наприклад, для реакції у газовій фазі:
 ;
;
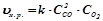 або
або 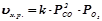 .
.
Швидкість гетерогенних хімічних реакцій залежить лише від концентрації речовин у рідкій чи газоподібній фазі. Тверді речовини у рівняння швидкості не включаються.
Наприклад:
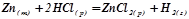 ;
;
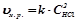 .
.
Залежність швидкості хімічної реакції від температури
Вплив температури на підвищення швидкості хімічної реакції пояснює теорія активації.
Надлишкова енергія, яку повинні мати молекули, щоб їх зіткнення могло призвести до утворення нової речовини, називається енергією активації (Еa, кДж/моль). Молекули, енергія яких досягає енергії активації, називаються активними.
Підвищення температури збільшує кінетичну енергію і кількість активних молекул, а це призводить до зростання швидкості хімічної реакції.
Взаємозв’язок між температурою, енергією активації та швидкістю хімічної реакції визначається рівнянням Арреніуса:
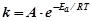 ,
,
де 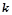 – константа швидкості;
– константа швидкості;
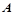 –множник Арреніуса, який оцінює кількість ефективних зіткнень;
–множник Арреніуса, який оцінює кількість ефективних зіткнень;
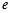 – основа натурального логарифма;
– основа натурального логарифма;
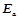 – енергія активації;
– енергія активації;
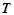 – температура.
– температура.
Наближено залежність швидкості реакції від температури визначають за правилом Вант-Гоффа: при підвищенні температури на кожні 10 градусів швидкість більшості гомогенних реакцій зростає в 2-4 рази.
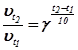 ,
,
де 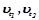 - швидкості реакції при температурах
- швидкості реакції при температурах 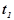 і
і 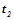 ;
;
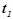 і
і 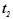 - початкова і кінцева температури;
- початкова і кінцева температури;
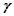 - температурний коефіцієнт швидкості: показує, у скільки саме разів змінюється швидкість даної реакції при зміні температури на кожні 10 градусів. Для більшості хімічних реакцій
- температурний коефіцієнт швидкості: показує, у скільки саме разів змінюється швидкість даної реакції при зміні температури на кожні 10 градусів. Для більшості хімічних реакцій 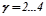 .
.
2. Каталіз та каталізатори
Каталізатори – це речовини, що збільшують швидкість реакції, кількісно і якісно при цьому не змінюючись. Речовини, що зменшують швидкість реакцій, називаються від’ємними каталізаторами, або інгібіторами.
Реакції, що відбуваються під дією каталізаторів, називаються каталітичними.
При гомогенному каталізі всі реагуючі речовини і каталізатор утворюють одну фазу (газоподібну або рідку).
При гетерогенному каталізі каталізатор перебуває в іншому агрегатному стані, ніж реагуючі речовини. Це, як правило, тверда речовина, на поверхні якої відбуваються каталітичні процеси.
3. Хімічна рівновага
Всі хімічні реакції можна поділити на оборотні і необоротні.
Реакції, що відбуваються в одному напрямку до повної витрати однієї з реагуючих речовин називаються необоротними.
Оборотними називаються реакції, які можуть відбуватися і в прямому, і в зворотному напрямках.
Більшість хімічних реакцій є оборотними. Вони закінчуються станом хімічної рівноваги.
Хімічною рівновагою називається стан оборотної реакції, при якому швидкість прямої реакції дорівнює швидкості зворотної (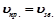 ). Концентрації компонентів реакції у стані рівноваги називаються рівноважними концентраціями і позначаються так:
). Концентрації компонентів реакції у стані рівноваги називаються рівноважними концентраціями і позначаються так: 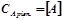 . Вони при даній температурі залишаються постійними. З умови рівності швидкостей прямої і зворотної реакції виводиться константа рівноваги:
. Вони при даній температурі залишаються постійними. З умови рівності швидкостей прямої і зворотної реакції виводиться константа рівноваги:

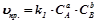 ;
; 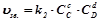 ;
; 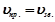 .
.
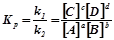 .
.
Стан хімічної рівноваги за сталих умов може зберігатись будь-який час. При зміні умов (температури, концентрації, тиску) рівновага порушується відповідно до принципу Ле Шательє: якщо на систему, що перебуває у стані рівноваги, подіяти ззовні, змінивши тиск, температуру чи концентрацію, то прискориться та реакція (пряма чи зворотна), що протидіє цій зміні.
Вплив концентрації.
При збільшені концентрації будь-якої з речовин, що належать до рівноважної системи, рівновага зміщується в напрямку витрати цієї речовини. При зменшенні концентрації якої-небудь з речовин рівновага зміщується в сторону утворення цієї речовини.
Вплив температури.
При підвищенні температури рівновага зміщується в сторону ендотермічної реакції, при зниженні – в сторону екзотермічної реакції.
Вплив тиску (при t, V = const).
Зміна тиску зміщує рівновагу системи, якщо хоч одна з реагуючих речовин знаходиться в газовій фазі і коли число моль газоподібних речовин в правій і лівій частині рівняння неоднакове. За таких умов підвищення тиску приводить до зміщення рівноваги в сторону реакції утворення меншого числа моль газоподібних речовин, а зниження тиску зміщує рівновагу в сторону утворення більшого числа моль газоподібних речовин.
|
|
