
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Соединения углерода с азотом. Синильная кислота и цианиды, их получение и свойства. Роданистоводородная кислота и ее соли; получение и свойства.
|
|
Взаимодействие углерода с азотом с получением циана (CN)2 происходит при пропускании электрического разряда между угольными электродами в атмосфере азота. Среди азотсодержащих соединений углерода важное практическое значение имеют цианистый водород HCN (синильная кислота) и его многочисленные производные.
Сини́ льная (циа́ нистоводородная) кислота́, цианистый водород, HCN — бесцветная, очень летучая, легкоподвижная ядовитая жидкость, имеющая характерный запах миндаля.
Молекула HCN сильно полярна (μ = 0, 96·10− 29 Кл·м).
Безводный цианистый водород является сильно ионизирующим растворителем, растворенные в нём электролиты хорошо диссоциируют на ионы. Его относительная диэлектрическая проницаемость при 25 °C равна 107 (выше, чем у воды). Это обусловлено линейной ассоциацией полярных молекул HCN за счет образования водородных связей.
Очень слабая одноосновная кислота К = 1, 32·10− 9 (18 °C). Образует с металлами соли — цианиды. Взаимодействует с оксидами и гидроксидами щелочных и щёлочноземельных металлов.
В настоящий момент существуют три наиболее распространенных метода получения синильной кислоты в промышленных масштабах:
· Метод Андрусова: прямой синтез из аммиака и метана в присутствии воздуха и платинового катализатора при высокой температуре:
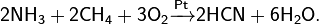
· Метод BMA (Blausä ure aus Methan und Ammoniak), запатентованный фирмой Degussa: прямой синтез из аммиака и метана в присутствии платинового катализатора при высокой температуре:
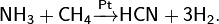
· Побочный продукт при производстве акрилонитрила путем окислительного аммонолиза пропилена.
Соли синильной кислоты называются цианидами. Цианиды подвержены сильному гидролизу. При хранении водных растворов цианидов при доступе диоксида углерода они разлагаются:

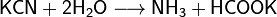
Ион CN− (изоэлектронный молекуле СО) входит как лиганд в большое число комплексных соединений d-элементов. Комплексные цианиды в растворах очень стабильны.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Цианиды тяжёлых металлов термически неустойчивы; в воде, кроме цианида ртути (Hg(CN)2), нерастворимы. При окислении цианиды образуют соли —цианаты:

Многие металлы при действии избытка цианида калия или цианида натрия дают комплексные соединения, что используется, например, для извлечения золота и серебра из руд:

Роданистоводородная кислота — желтоватая, маслянистая, резко пахнущая жид-кость. Химическая формула HNCS.
Физико-химические свойства.
Роданистоводородная кислота устойчива только при низких температурах (около − 90 °C) или в разбавленныхводных растворах (менее чем в 5%-ных). Является сильной кислотой — её растворы почти полностью диссоциированы. Хорошо растворяется в воде и ряде органических растворителей (этанол, диэтиловыйэфир, бензол)
В интервале от − 90 °C до − 85 °C полимеризуется в бесцветную кристаллическую массу. При слабомнагревании в вакууме образуется родануровая кислота (HNCS)3, которая переходит обратно в HNCS при 3-5 °C. Водные растворы устойчивы до 5 % концентрации, в более концентрированных растворах разлагается, переходя в т. н. ксантогеновый водород и ряд других продуктов.
Реагирует со щелочными металлами. Восстанавливается цинком в соляной кислоте до метиламина и 1, 3, 5-тритиана (тример тиоформальдегида). Окисляется перманганатом калия до серной кислоты, пероксидом водорода — до синильной кислоты, бромом — до цианида брома. Медленное окисление приводит к родану (SCN)2. Сероводородом разлагается до сероуглерода и аммиака. Присоединяется к ненасыщенным соединениям. Соли этой кислоты называются тиоцианатами.
Практическое применение находят только её соли, а также сложные эфиры, используемые как инсектициды и фунгициды.
17. Кремний – нахождение в природе, методы получения кремния, свойства и применение.
Кре́ мний — элемент главной подгруппы четвёртой группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14. Обозначается символом Si, неметалл.
Содержание кремния в земной коре составляет по разным данным 27, 6—29, 5 % по массе. Таким образом, по распространённости в земной коре кремний занимает второе место после кислорода. Концентрация в морской воде 3 мг/л.
Чаще всего в природе кремний встречается в виде кремнезёма — соединений на основе диоксида кремния (IV) SiO2 (около 12 % массы земной коры). Основные минералы и горные породы, образуемые диоксидом кремния, — это песок (речной и кварцевый), кварц и кварциты, кремень, полевые шпаты. Вторую по распространённости в природе группу соединений кремния составляют силикаты и алюмосиликаты.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Отмечены единичные факты нахождения чистого кремния в самородном виде.
Свободный кремний получается при прокаливании мелкого белого песка (диоксида кремния) с магнием:

При этом образуется аморфный кремний, имеющий вид бурого порошка.
В промышленности кремний технической чистоты получают, восстанавливая расплав SiO2 коксом при температуре около 1800 °C в руднотермических печах шахтного типа. Чистота полученного таким образом кремния может достигать 99, 9 % (основные примеси — углерод, металлы).
Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом.
При нормальных условиях кремний химически малоактивен и активно реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. Такая «неактивность» кремния связана с пассивацией поверхности наноразмерным слоем диоксида кремния, немедленно образующегося в присутствии кислорода, воздуха или воды (водяных паров).
При нагревании до температуры свыше 400—500 °C кремний реагирует с кислородом с образованием диоксида SiO2, процесс сопровождается увеличением толщины слоя диоксида на поверхности, скорость процесса окисления лимитируется диффузией атомарного кислорода сквозь плёнку диоксида.
При нагревании до температуры свыше 400—500 °C кремний реагирует с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4 и, возможно, галогенидов более сложного состава.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем.
С азотом и бором кремний реагирует при температуре около 1000 °C, образуя соответственно нитрид Si3N4 и термически и химически стойкие боридыSiB3, SiB6 и SiB12.
Сверхчистый кремний преимущественно используется для производства одиночных электронных приборов (нелинейные пассивные элементы электрических схем) и однокристальных микросхем. Чистый кремний, отходы сверхчистого кремния, очищенный металлургический кремний в виде кристаллического кремния являются основным сырьевым материалом для солнечной энергетики.
Монокристаллический кремний — помимо электроники и солнечной энергетики, используется для изготовления зеркал газовых лазеров.
Соединения кремния служат основой для производства стекла и цемента. Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс и изделия из них.
Широко известен силикатный клей, применяемый в строительстве как сиккатив, а в пиротехнике и в быту для склеивания бумаги.
Получили широкое распространение силиконовые масла и силиконы — материалы на основе кремний органических соединений.
18. Кремниевые кислоты. Силикагель. Силикаты и алюмосиликаты. Кремнекислородный тетраэдр – основа структуры кристаллических решеток силикатов. Ситаллы. Цеолиты.
Кремниевые кислоты — очень слабые, малорастворимые в воде кислоты общей формулы nSiO2•mH2O.
Кремниевые кислоты растворяются в растворах и расплавах щелочей, образуя силикаты:

Растворы кремниевых кислот получают растворением аморфного диоксида кремния в воде, действием сильных кислот на растворимые силикаты натрия или калия:

гидролизом хлорсиланов:

а также методами электродиализа и ионного обмена.
Гидрозоли кремниевых кислот используются как наполнители и связующие материалы в производстве керамических изделий, различных покрытий. Они используются как носители катализаторов и светочувствительных слоёв в фотоматериалах. Они служат сырьём для получения кварцевого стекла, различных адсорбентов, поглотителей паров воды и газов, фильтров очистки воды и масел.
Силикаге́ ль представляет собой высушенный гель, образующийся из перенасыщенных растворов кремниевых кислот (n SiO2· m H2O) при pH > 5—6. Твёрдый гидрофильный сорбент.
Получается при подкислении растворов силикатов щелочных металлов с последующей промывкой и высушиванием образовавшегося геля:


Основное применение силикагели находят при осушке воздуха, углекислого газа, водорода, кислорода, азота, хлора и других промышленных газов.
Силикаты и алюмосиликаты представляют собой обширную группу минералов. Для них характерен сложный химический состав и изоморфные замещения одних элементов и комплексов элементов другими.
Силикаты и алюмосиликаты являются породообразующими минералами. Из них сложена основная масса горных пород: полевые шпаты, кварц, слюды, роговые обманки, пироксены, оливин и др.
Силикаты — важные неметаллические полезные ископаемые: асбест, тальк, слюды, каолин, керамическое и огнеупорное сырьё, строительные материалы. Кроме того они широко известны как драгоценные и поделочные камни: изумруд, аквамарин, топаз, нефрит, родонит и др.
Кристаллохимические исследования силикатов показали, что они не имеют молекул, а их структура образована ионами, то есть силикаты обладают ионными кристаллическими решетками.
1. В основе структур силикатов лежит кремнекислородный тетраэдр [SiO4]. Различные по форме сочетания взаимосвязанных кремнекислородных тетраэдров называют кремнекислородными мотивами.
2. Кремнекислородные тетраэдры соединяются друг с другом вершинами через кислород, образуя силоксановую связь Si – O – Si. Эта связь на 50% ионная; энергия связи составляет 470 кДж/моль. Связь тетраэдров осуществляется только через кислородные вершины и это приводит к образованию устойчивых структур.
3. Для силикатных структур характерным является замещение катиона кремния на катион алюминия. При координационном числе 4 алюминий может замещать кремний в кремнекислородном мотиве, алюминий с координационным числом 6 играет роль связующего катиона между мотивами. В первом случае силикаты получили название алюмосиликатов, во втором – силикатов алюминия.
4. В силикатных структурах развит изовалентный и гетеровалентный изоморфизм.
5. Большинство структур силикатов не подчиняются закону плотнейших упаковок.
Ситаллы — стеклокристаллические материалы, полученные объёмной кристаллизацией стекол, и состоящие из одной или нескольких кристаллических фаз, равномерно распределённых в стекловидной фазе.
Ситаллы обладают малой плотностью, высокой механической прочностью, особенно на сжатие, твердостью, жаропрочностью, термической стойкостью, химической устойчивостью и другими ценными свойствами. Ситаллы имеют большинство положительных свойств, которые есть у стекла, в том числе и технологичность.
Подбором состава стекла, содержащего в большинстве случаев добавки, ускоряющие объёмную кристаллизацию (катализаторы, нуклеаторы), можно спроектировать соответствующие кристаллические и стекловидную фазы. Кристаллы спроектированных фаз возникают и растут равномерно по всему объёму в результате термической обработки. Технология производства изделий из ситаллов незначительно отличается от производства изделий из стекла. В некоторых случаях изделия можно формовать методами керамической технологии. Иногда для зарождения кристаллов в состав стекла вводят фоточувствительные добавки. Для производства отдельных видов ситаллов используют шлаки.
Существуют литиевые, борно-бариевые, магниевые, титановые и другие ситаллы.
Ситаллы применяются для изготовления деталей, требующих прочности и термостойкости (корпуса приборов, шкалы, образцовые меры, подложкимикросхем и др.).
Цеолиты — большая группа близких по составу и свойствам минералов, водные алюмосиликаты кальция и натрия из подкласса каркасных силикатов, со стеклянным или перламутровым блеском, известных своей способностью отдавать и вновь поглощать воду в зависимости от температуры и влажности. Другим важным свойством цеолитов является способность к ионному обмену — они способны селективно выделять и вновь впитывать различные вещества, а также обменивать катионы.
Наиболее распространённые представители группы цеолитов — натролит, шабазит, гейландит, стильбит (десмин), морденит, томсонит, ломонтит.
Кристаллическая структура цеолитов природных и искусственных образована тетраэдрическими группами SiO2/4 и AlO2/4, объединёнными общими вершинами в трёхмерный каркас, пронизанный полостями и каналами (окнами) размером 2-15 ангстрем. Открытая каркасно-полостная структура цеолитов [AlSi]O4− имеет отрицательный заряд, компенсирующийся противоионами (катионами металлов, аммония, алкиламмония и др. ионов, введённых по механизму ионного обмена) и легко дегидратирующимися молекулами воды.
Искусственно синтезированные цеолиты (пермутиты) находят широкое применение в водоочистительных приборах в качестве адсорбентов, ионообменников, молекулярных сит; применяют в качестве доноров и акцепторов электронов. Используются в вакуумных насосах сорбционного типа. Также цеолиты получили весьма широкое применение как катализаторы многих процессов нефтехимии и нефтепереработки и как гетерогенные катализаторы.
|
|
