
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Углерод. Аллотропия. Химические свойства углерода. Карбиды металлов. Сероуглерод, способы получения и свойства.
|
|
Углеро́ д С— химический элемент четырнадцатой группы, 2-го периода периодической системы химических элементов. порядковый номер 6, атомная масса — 12, 0107.
При обычных температурах углерод химически инертен, при достаточно высоких соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—500 °C, 600—700 °C и 850—1000 °C.
Аллотропия:
Электронные орбитали атома углерода могут иметь различную геометрию, в зависимости от степени гибридизации его электронных орбиталей. Существует три основных геометрии атома углерода.
- тетраэдрическая, образуется при смешении одного s- и трех p-электронов (sp3-гибридизация). Атом углерода находится в центре тетраэдра, связан четырьмя эквивалентными σ -связями с атомами углерода или иными в вершинах тетраэдра. Такой геометрии атома углерода соответствуют аллотропные модификации углерода алмаз и лонсдейлит. Такой гибридизацией обладает углерод, например, в метане и других углеводородах.
- тригональная, образуется при смешении одной s- и двух p-электронных орбиталей (sp² -гибридизация). Атом углерода имеет три равноценные σ -связи, расположенные в одной плоскости под углом 120° друг к другу. Не участвующая в гибридизации p-орбиталь, расположенная перпендикулярно плоскости σ -связей, используется для образования π -связи с другими атомами. Такая геометрия углерода характерна для графита, фенола и др.
- дигональная, образуется при смешении одного s- и одного p-электронов (sp-гибридизация). При этом два электронных облака вытянуты вдоль одного направления и имеют вид несимметричных гантелей. Два других р-электрона дают π -связи. Углерод с такой геометрией атома образует особую аллотропную модификацию — карбин.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Химические свойства углерода
1)Взаимодействие с фтором. Углерод обладает низкой реакционной способностью, из галогенов реагирует только с фтором:
С + 2F2 = CF4.
2)Взаимодействие с кислородом. При нагревании взаимодействует с кислородом, образуя оксиды СО и СО2:
2С + О2 = 2СО,
С + О2 = СО2.
3)Взаимодействие с другими неметаллами. Реагирует с серой, не взаимодействует с азотом и фосфором:
С + 2S = CS2.
Реагирует с водородом в присутствии никелевого катализатора, образуя метан:
C + 2H2 = CH4.
4)Взаимодействие с металлами. Способен взаимодействовать с металлами, образуя карбиды:
Ca + 2C = CaC2.
5)Взаимодействие с водой. При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород:
C + H2O = CO + H2.
6) Восстановительные свойства. Углерод способен восстанавливать многие металлы из их оксидов:
2ZnO + C = 2Zn + CO2.
7)Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV):
C + 2H2SO4 = CO2 + 2SO2 + 2H2O;
C + 4HNO3 = CO2 + 4NO2 + 2H2O.
Карби́ ды — соединения металлов и неметаллов с углеродом. Традиционно к карбидам относят соединения, где углерод имеет большую электроотрицательность, чем второй элемент (таким образом из карбидов исключаются такие соединения углерода, как оксиды, галогениды и т.п.).
Карбиды — тугоплавкие твёрдые вещества. Они нелетучи и не растворимы ни в одном из известных растворителей. Карбиды бора и кремния (В4С и SiC), титана, вольфрама, циркония (TiC, WC и ZrC соответственно) обладают высокой твёрдостью, жаростойкостью, химической инертностью.
Карбиды применяют в производстве чугунов и сталей, керамики, различных сплавов, как абразивные и шлифующие материалы, как восстановители, раскислители, катализаторы и др. WC и TiC входят в состав твердых сплавов, из которых готовят режущий инструмент; карбид кальция СаС2 используют для получения ацетилена; из карбида кремния SiC (карборунд) готовят шлифовальные круги и другие абразивы; карбид железа Fe3C (цементит) входит в состав чугунов и сталей, из карбида вольфрама и карбида хрома производят порошки, используемые при газотермическом напылении.
Карбиды могут быть образованы разными органическими соединениями, а могут не иметь аналогов среди органических веществ. Металлоподобные карбиды (имеющие нестехиометрический состав, например, цементит (Fe3C)) имеют промежуточную химическую активность.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Сероуглерод CS2 — соединение серы с углеродом.
В промышленности получают по реакции метана с парами серы в присутствии силикагеля при 500—700 °C в камере из хромоникелевой стали:

Также сероуглерод можно получить взаимодействием древесного угля и паров S при 750—1000 °C.
Чистый сероуглерод представляет собой бесцветную жидкость с приятным «эфирным» запахом. Технический продукт, полученный сульфидированием угля, имеет неприятный «редечный» запах. Молекула CS2 линейна, длина связи С—S = 0, 15529 нм; энергия диссоциации 1149 кДж/моль.
Сероуглерод токсичен, огнеопасен, имеет самый широкий диапазон концентрационных пределов взрываемости.
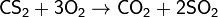
Подобно диоксиду углерода, CS2 является кислотным ангидридом и при взаимодействии с некоторыми сульфидами может образовывать соли тиоугольной кислоты (Н2СS3). При реакции со щелочами образуются соли дитиоугольной кислоты и продукты их диспропорционирования.
Однако, сероуглерод, в отличие от диоксида углерода, проявляет большую реакционную способность по отношению к нуклеофилам и легче восстанавливается. Такими сильными окислителями, как, например, перманганат калия, сероуглерод разлагается с выделением серы.
14. Монооксид углерода – строение молекулы, получение и свойства. Генераторный и водяной газы. Карбонилы металлов: свойства, их получение.
Моноокси́ д углеро́ да (уга́ рный газ, о́ кись углеро́ да, оксид углерода(II)) — бесцветный ядовитый газ без вкуса и запаха, легче воздуха (при нормальных условиях). Химическая формула — CO.
Молекула CO имеет тройную связь, как и молекула азота N2. Так как эти молекулы сходны по строению (изоэлектронны, двухатомны, имеют близкую молярную массу), то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
В рамках метода валентных связей строение молекулы CO можно описать формулой: C≡ O:.
Благодаря наличию тройной связи молекула CO весьма прочна и имеет малое межъядерное расстояние.
Оксид углерода(II) горюч. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
Основными типами химических реакций, в которых участвует оксид углерода (II), являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах. Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора.
Оксид углерода(II) незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако реагирует с расплавами щелочей с образованием соответствующих формиатов:

Важнейшим свойством оксида углерода(II) является его способность реагировать с водородом с образованием органических соединений (процесс синтеза Фишера — Тропша):
 спирты + линейные алканы.
спирты + линейные алканы.
Этот процесс является источником производства таких важнейших промышленных продуктов как метанол, синтетическое дизельное топливо, многоатомные спирты, масла и смазки.
Получение.
|
|
