
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химические свойства азота
|
|
Его основное свойство в нормальных условиях – это инертность, т.е. минимальная химическая активность. Атом азота может образовывать связь с другим атомом азота, что достаточно необычно для химических элементов (исключение составляют лишь кремний и углерод).
При нагревании этот элемент реагирует с большинством металлов. При этом образуются ионные, ковалентные или промежуточные нитриды с отрицательно заряженным ионом азота.
В реакции с водородом азот образует достаточно устойчивые соединения – азотоводороды, которые отдаленно напоминают углеводороды. К подобным веществам относятся аммиак, гидразин и азотистоводородная кислота.
Причина инертности молекулярного азота – крайне прочная ковалентная неполярная связь. Два атома в молекуле удерживаются одной σ - связью и двумя π - связями. Т.е. связи в молекуле азота неравноценны. На разрушение молекулы азота на атомы затрачивается довольно большое количество энергии:
N2 = 2N ∆ H0 = 946 кДж/моль
Аммиа́ к (нитрид водорода) - химическое соединение с формулой NH3, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта и мочи).
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N− H), четвёртая пара внешних электронов является неподелённой, она может образоватьковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток, хорошй растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — бесцветные кубические кристаллы.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: 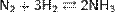 + 91, 84 кДж
+ 91, 84 кДж
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо.
Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а не прореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления.
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:

Обычно лабораторным способом аммиак получают слабым нагреванием смеси хлорида аммония с гашеной известью.

Для осушения аммиака его пропускают через смесь извести с едким натром.
Очень сухой аммиак можно получить, растворяя в нём металлический натрий и впоследствии перегоняя. Это лучше делать в системе, изготовленной из металла под вакуумом. В промышленности аммиак осушают в абсорбционных колоннах.
Все соли аммония хорошо растворимы в воде и полностью диссоциируют в водном растворе. Соли аммония проявляют общие свойства солей. При действии на них щёлочи выделяется газообразный аммиак. Все соли аммония при нагревании разлагаются.
Химические свойства:
1. Сильные электролиты (диссоциируют в водных растворах):
NH4Cl ↔ NH4+ + Cl−
2. Разложение при нагревании:
а) если кислота летучая
NH4Cl → NH3↑ + HCl
NH4HCO3 → NH3↑ + Н2O + CO2
б) если анион проявляет окислительные свойства
NH4NO3 → N2O↑ + 2Н2O
(NH4)2Cr2O7 → N2↑ + Cr2O3+ 4Н2O
3. С кислотами (реакция обмена):
(NH4)2CO3 + 2HCl → 2NH4Cl + Н2O + CO2 ↑
2NH4+ + CO32− + 2H+ + 2Cl− → 2NH4+ + 2Cl− + Н2O + CO2 ↑
CO32− + 2H+ → Н2O + CO2 ↑
4. C солями (реакция обмена):
(NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3
2NH4+ + SO42− + Ba2+ + 2NO3− → BaSO4 ↓ + 2NH4+ + 2NO3−
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Ba2+ + SO42− → BaSO4 ↓
5. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) — среда кислая:
NH4Cl + Н2O ↔ NH4OH + HCl
NH4+ + Н2O ↔ NH4OH + H+
6. При нагревании со щелочами выделяют аммиак (качественная реакция на ион аммония)
NH4Cl + NaOH → NaCl + NH3 ↑ + Н2O
Нитриды — соединения азота с менее электроотрицательными элементами, например, с металлами (AlN; TiNx; Na3N; Ca3N2; Zn3N2; и т. д.) и с рядом неметаллов (NH3, BN, Si3N4).
Нитриды ионного типа получаются при взаимодействии металлов с азотом при температурах 700—1200 °C. Другие нитриды можно получить взаимодействием металла с азотом или аммиаком или восстановлением оксидов, хлоридов металла углеродом в присутствии азота или аммиака при высоких температурах. Нитриды образуются также в плазме в дуговых, высокочастотных и сверхвысокочастотных плазмотронах.
Нитриды ионного типа легко разлагаются водой и кислотами, проявляя основные свойства:


Нагревание нитридов элементов V, VI и VIII групп приводит к их разложению с выделением азота, низших нитридов и твердых растворов азота в металлах.
Окисление нитридов кислородом приводит к образованию оксидов металлов и азота.
25. Гидроксиламин и гидразин, их соли – строение молекул, получение, свойства, применение. Гидраты гидразина и гидроксиламина, их свойства.
Гидразин (NH2NH2) – это сильно гигроскопическая жидкость, обладающая заметной способностью поглощать из воздуха углекислоту и кислород. Гидразин хорошо растворяется в воде, спиртах, аммиаке, аминах. Он нерастворим в углеводородах и их галоидопроизводных. Водные растворы обладают основными свойствами. Гидразин является сильным восстановителем. Благодаря этому он термодинамически неустойчив и легко разлагается под влиянием катализаторов, при нагревании до высоких температур, при действии излучений. На воздухе горит синим пламенем. При этом выделяется значительное количество энергии.
В промышленности гидразин получают по методу Рашига, первая стадия которого состоит в действии хлора на аммиак, в результате чего образуется непрочный хлорамин:
Хлорамин далее взаимодействует с избытком аммиака в щелочной среде по уравнению
NH2Cl + NH3 + NaOH = NH2-NH2 + NaCl + H2O
Химические свойства гидразина определяются, во-первых, тем, что его молекула состоит из двух аминогрупп, обладающих слабо основными свойствами. В соответствии с этим гидразин как слабое основание может реагировать как с одной, так и с двумя молекулами одноосновной кислоты, например соляной:
N2H4 + HCl = N2H5Cl
N2H4 + 2HCl = N2H6Cl2
Его реакция с серной кислотой приводит к гидразин-сульфату(N2H6SO4) который, как всякая соль, является твердым веществом, хорошо растворимым в воде. Гидразин-сульфат под названием " Сигразин" нашел применение в медицине при лечении больных раком. Онкологические больные обычно испытывают сильное истощение, быструю потерю веса и аппетита. Эти явления вызываются нарушениями углеводного обмена.
Другая особенность гидразина - его сильнейшие восстановительные свойства, что вызвано как присутствием в его молекуле непрочной связи азот-азот, так и аномальной степенью окисления атомов азота (-2). В качестве примера восстановительных свойств гидразина можно привести его реакцию с перманганатом калия, которую можно использовать для аналитического определения гидразина, как и реакции с некоторыми другими окислителями:
5(NH2-NH2) + 4KMnO4 + 6H2SO4 =5N2 + 2K2SO4 + 4MnSO4 + 16H2O
Гидразин сгорает на воздухе, причем эта реакция сильно экзотермична и приводит к образованию газообразных продуктов:
NH2-NH2 + O2= N2 + 2H2O + 149, 5 ккал/моль
Известны соли гидразина — хлорид гидразиния N2H5Cl, сульфат гидразония N2H6SO4 и т. д. Большинство таких солей растворимо в воде.

Соли гидразина бесцветны, почти все хорошо растворимы в воде. К числу важнейших относится сульфат гидразина N2H4 · H2SO4.
Гидразин применяют в органическом синтезе, в производстве пластмасс, резины, инсектицидов, взрывчатых веществ, в качестве компонента ракетного топлива.
Гидразина сульфат применяется в случае таких заболеваний, как неоперабельные прогрессирующие распространенные формы, рецидивы и метастазы злокачественных опухолей — рак легкого (особенно немелкоклеточный), молочных желез, желудка, поджелудочной железы, гортани, эндометрия, шейки матки, десмоидный рак, саркома мягких тканей, фибросаркома, нейробластома, лимфогранулематоз, лимфосаркома (моно-терапия или в составе полихимиотерапии).
Гидразин-гидрат — бесцветная жидкость, легко поглощает из воздуха воду, углекислоту и кислород, хорошо растворим в воде и спирте, токсичен, а при концентрациях, превышающих 40% горюч.
|
|
