
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Оксиды, гидроксиды и соли олова (II) и свинца (II); их получение и свойства. Солеобразные оксиды свинца.
|
|
Оксид олова(II) — неорганическое бинарное химическое соединение олова и кислорода, химическая формула SnO, черно-синие кристаллы (по другим данным коричневато-чёрные).
Оксид олова является полупроводником, тип проводимости которого зависит от примесей и способа получения.
Оксид олова получают осторожным разложением в инертной атмосфере гидроокиси олова:

Из диоксида олова:

В лабораторных условиях оксид олова часто получают осторожным нагревом оксалата олова(II) в инертной атмосфере:

С помощью твёрдотельной реакции из хлорида олова(II):

Оксид олова(II) устойчив на воздухе, амфотерен с преобладанием основных свойств. Мало растворим в воде и разбавленных растворах щелочей.
Гидроксид олова(II) — неорганическое соединение, гидроокись олова формулой Sn(OH)2, гелевидный белый осадок, плохо растворимый в воде, проявляет амфотерные свойства.
Получают осаждением щелочами из раствора солей двухвалентного олова:

Гидроксид олова(II) образует гелевидный белый осадок, плохо растворимый в воде, устойчивый в интервале p H 2, 5÷ 10, 5.
Химические свойства
· При нагревании легко теряет воду:

· Проявляет амфотерные свойства, растворяется в кислотах:

· и щелочах:

Хлорид олова(II) (SnCl2) — белый порошок. Плавится и кипит без разложения. При стоянии на воздухе постепенно гидролизуется влагой и окисляется O2. Хорошо растворяется в малом количестве воды, при разбавлении раствора выпадает в осадок. Соль SnCl2 ∙ 2H2O имеет строение [Sn(H2O)Cl2] ∙ 2H2O («оловянная соль»). Реагирует со щёлочами, гидратом аммиака. Сильный восстановитель, слабый окислитель.
Получение
· Кристаллизация водного раствора хлористого олова;
· Растворение олова в соляной кислоте;
· Нагревание олова в токе хлористого водорода.
Оксид свинца(II) — бинарное неорганическое соединение металла свинца и кислорода с формулой PbO, красные или жёлтые кристаллы, плохо растворимые в воде.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Получение:
· Пропуская воздух через расплавленный свинец:

· Нагревание гидроксида свинца:

· Нагревание карбоната свинца:

· Разложение нитрата свинца:

· Разложение диоксида свинца:

· Окисление сульфида свинца:

Оксид свинца(II) диамагнитен, обладает полупроводниковыми свойствами, тип проводимости зависит от состава.
Химические свойства:
· Проявляет амфотерные свойства, реагирует с кислотами:
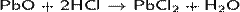
· и щелочами:

· Во влажном состоянии поглощает углекислоту с образованием основной соли:

· Окисляется кислородом:

· Бромом в водной суспензии окисляется до диоксида свинца:

Гидроксид свинца(II) — неорганическое соединение, гидроокись металла свинца с формулой Pb(OH)2, белое аморфное вещество или прозрачные кристаллы, плохо растворимые в воде.
Получение
· Осаждение щелочью растворимой соли двухвалентного свинца:

· Окисление свинца в присутствии воды при нагревании:

Химические свойства:
· При нагревании разлагается:

· Проявляет амфотерные свойства, реагирует с кислотами:

· и щелочами:

· Поглощает углекислоту с образованием основной соли:

· В щелочной среде окисляется перекисью водорода:

Соли свинца(II):
Сульфа́ т свинца́ (II) (свинцовый купорос) — PbSO4. В природе распространён как минерал англезит. Применяется как компонент пигментов. Образуется в свинцово-кислотных аккумуляторных батареях при разряде.
Температура плавления: 1170 °C (с разложением). Практически не растворим в воде.
Нитрат свинца(II) (динитрат свинца) — неорганическое химическое соединение с химической формулой Pb (NO3)2. В обычном состоянии — бесцветные кристаллы или белый порошок. Хорошо растворим в воде.
Динитрат свинца не встречается в природе. Промышленные и лабораторные методы его получения сводятся к растворению в разбавленной азотной кислоте свинца, его оксида или гидроксида:



кислоту берут с избытком для подавления гидролиза и снижения растворимости нитрата свинца.
При очистке азотной кислотой отходов, содержащих свинец, например, при обработке свинцово-висмутных отходов на заводах, образуется динитрат свинца как побочный продукт. Эти соединения используются в процессе цианирования золота.
Ацетат свинца(II) (свинец уксуснокислый) — химическое соединение, свинцовая соль уксусной кислоты. Химическая формула: Pb(CH3COO)2. Образует кристаллогидраты: Pb(CH3COO)2·3H2O (свинцовый сахар) и Pb(CH3COO)2·10H2O.
В нормальных условиях представляет собой прозрачные кристаллы. Тригидрат имеет сладкий вкус, однако, как и другие соединения свинца, он сильно токсичен.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Ацетат свинца(II) получают взаимодействием уксусной кислоты с оксидом или карбонатом свинца(II):


Также можно растворить в уксусной кислоте свинец при нагревании и в присутствии кислорода (воздуха):

При выпаривании раствора ацетат свинца(II) выпадают кристаллы тригидрата Pb(CH3COO)2·3H2O. Для получения кристаллов безводного ацетата свинца необходимо проводить упаривание при большом избытке уксусной кислоты.
Цена на ацетат свинца категории «чистый» около 5500 $/т.
Образует бесцветные прозрачные кристаллы. Безводный ацетат свинца плавится при 280 °С с частичной возгонкой и разложением на Pb, CO2, H2O и ацетон.
Хромат свинца(II) — неорганическое соединение, соль металла свинца и хромовой кислоты с формулой PbCrO4, жёлтые кристаллы, не растворимые в воде.
Получение
· В природе встречается минерал крокоит — хромат свинца с примесями серебра и цинка.
· Действие хромата калия на нитрат свинца:

Химические свойства:
· Растворяется в концентрированных кислотах:

· и щелочах:

Солеобразные оксиды – это двойные оксиды, в состав которых входят атомы одного металла в разных степенях окисления.
Металлы, проявляющие в соединениях несколько степеней окисления, образуют двойные, или солеобразные оксиды. Например, Pb3O4,
От гидрата оксида свинца (IV), как от кислоты, и Pb(OH2), как основания, могут быть получены два двойных оксида Pb2O3, Pb3O4 (сурик), которые можно рассматривать как соли. Первый является свинцовой солью метасвинцовой кислоты (H2PbO3), а второй – ортосвинцовой кислоты (H4PbO4).
Солеобразные оксиды не проявляют ни кислотных, ни основных свойств. Ведь данные свойства сводятся к образованию солей, а солеобразные оксиды – это уже соли.
23. Диоксиды олова и свинца; химические свойства и методы получения. Гидроксиды и галогениды олова (IV) и свинца (IV) – получение и свойства.
Диоксид (или двуокись) олова Sn02 встречается в природе и может быть получен искусственно сжиганием металла на воздухе или окислением его азотной кислотой с последующим прокаливанием полученного продукта. Применяется диоксид олова для приготовления белых глазурей и эмалей.
Гидроксиды олова (IV) называются оловянными кислотами и известны в двух модификациях: в виде а-оловянной кислоты и в виде р-оловянной кислоты.
а-Оловянная кислота H2Sn03 может быть получена действием водного раствора аммиака на раствор хлорида олова (IV)г.
SnCI4 + 4NH4OH = H2Sn03{. + 4NH4CI + H20
Выпадающий белый осадок при высушивании постепенно теряет воду, превращаясь в диоксид олова. Таким образом, кислоты определенного состава получить не удается. Поэтому приведенная выше формула ос-оловянной кислоты является лишь простейшей из возможных. Правильнее было бы изобразить состав этой кислоты формулой mSn02-ttH20.
а-Оловянная кислота легко растворяется в щелочах, образуя соли, содержащие комплексный анкон [Sn(OH)6]2~ и называемые гидроксостаннатами:
H2Sn03 + 2NaOH + Н20 = Na2[Sn(OH)6]
Гидроксостаннат натрия выделяется из растворов в виде кристаллов, состав которых можно выразить формулой Na2Sn03-3H20. Эта соль применяется в качестве протравы в красильном деле и для утяжеления шелка. Шелковые ткани, обработанные перед Крашением растворами соединений олова, иногда содержат, до 50 (масс.) олова,
Кислоты также растворяют а-оловянную кислоту с образованием солей олова (IV).
H2Sn03 + 4НС1 SnCl4 + 3H20
При избытке соляной кислоты хлорид олова(IV) присоединяет две молекулы хлороводорода, образуя комплексную гексахлорооловянную (или оловянохлористоводородную) кислоту Н2 [SnCl6]«Аммонийная соль этой кислоты (NH4)2 [SnCU] имеет то же применение, что и гидроксостаннат натрия.
Р-Оловянная кислота получается в виде белого порошка при действии концентрированной азотной кислоты на олово. Состав ее столь же неопределенен, как и состав а-оловянной кислоты. В отличие от а-оловянной кислоты, она не растворяется ни в кислотах, ни в растворах щелочей. Но путем сплавления со щелочами можно перевести ее в раствор в виде станната. а-Оловянная кислота при хранении ее в соприкосновении с раствором, из которого она выделилась, постепенно тоже превращается в р-оловянную кислоту.
Галогениды олова(IV) ближе к галогенангидридам, чем к солям. Их гидролиз протекает вплоть до образования гидроксида, который за счет полимеризации переходит в SnO2nH× 2O.
SnCl4+ 4H2O = Sn(OH)4+ 4HCl
Тетрагалогениды также взаимодействуют с основными галогенидами:
SnF4+ 2KF = K2[SnF6]
Диоксид (или двуокись) свинца РЬ02 — темно-бурый порошок, образующийся при действии сильных окислителей на оксид или соли свинца (II). Диоксид свинца представляет собой амфотерный оксид с преобладанием кислотных свойств.
Основные свойства диоксида свинца проявляются в образовании очень нестойких солей свинца (IV). Так, при действии на диоксид свинца соляной кислоты в первый момент образуется хло- рид свинца(IV) РЬС14, который, однако, легко отщепляет хлор, переходя в хлорид свинца (II) РЬС12:
Pb02 + 4НС1 = РЬС14 + 2Н20 РЬС14 = РЬС12 + Cl2f
Все соединения свинца (IV) сильные окислители.
Из галогенидов свинца(IV) известны только фторид и хлорид.
Фторид свинца (IV) PbF4 имеет кристаллическую слоистую решетку и, в отличие от хлорида, устойчив. PbCl4 представляет собой маслянистую жидкость желтого цвета, крайне неустойчив, получается при глубоком охлаждении продуктов реакции оксида свинца(IV) с концентрированной хлороводородной кислотой.
Хлорид свинца (IV) PbCl4. Желтая маслянистая жидкость, дымящая на воздухе. Взрывается при 105°С. Мало растворим в концентрированной серной кислоте, растворяется в бензоле. Гидролизуется водой. Присоединяет аммиак. Получают действием хлороводородной кислоты на диоксид свинца.
24. Азот. Причины инертности молекулярного азота. Аммиак – строение молекулы, способы получения, свойства. Соли аммония, их свойства. Нитриды.
Азот — двухатомный газ без цвета, вкуса и запаха. Один из самых распространённых элементов на Земле. Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов. Основной компонент воздуха (78, 09 % объёма), разделением которого получают промышленный азот, (более ¾ идёт на синтез аммиака). Применяется как инертная среда для множества технологических процессов; жидкий азот — хладагент.
|
|
