
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Способы устранения жесткости
|
|
Первый и самый простой способ – термический. Необходимо лишь вскипятить воду, из-за чего нестойкие гидрокарбонаты магния и кальция начнут разлагаться. Этим вы устраните временную жесткость воды. Кроме того, результатом разложения солей будет являться накипь.
Также можно попробовать реагентное умягчение воды. В нее необходимо добавить кальцинированную соду или гашеную известь. При этом методе соли магния и кальция превращаются в нерастворимое соединение и выпадают в осадок. Оптимальным средством устранения жесткости считается ортофосфат натрия. Он входит в состав многих препаратов бытового и производственного значения.
Еще одним способом будет являться катионирование. В воду необходимо поместить ионообменную регулируемую загрузку. Чаще всего используют ионообменную смолу. При соприкосновении с водой она поглощает катионы солей. Забирая их у кальция, магния, железа и марганца, она отдает ионы натрия и водорода, а вода становится мягкой.
Можно использовать обратный осмос. Нужно пропустить воду через полупроницаемые мембраны. При этом из воды уберутся большинство солей, в том числе и те, что отвечают за жесткость. Эффективность такого метода иногда достигает почти 100%.
8. Бор, способы получения и свойства. Соединения с водородом, бориды – получение, свойства, применение.
Бор — элемент тринадцатой группы, второго периода периодической системы химических элементов с атомным номером 5. Обозначается символом B (лат. Borum).
В свободном состоянии бор — бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество.
Получение:
· Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических синтезов.

· Метод металлотермии (чаще восстановление магнием или натрием):
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение


· Термическое разложение паров бромида бора на раскаленной (1000—1200 °C) вольфрамовой проволоке в присутствии водорода (метод Ван-Аркеля):

Физические свойства.
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду бора (боразону)). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
У бора — самый высокий предел прочности на разрыв 5, 7 ГПа.
Химические свойства
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:

При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:

С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:

При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
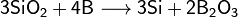

Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты H3BO3.
Оксид бора B2O3 — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
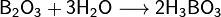
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анионBO33− ), а тетрабораты, например:
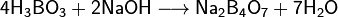
Бори́ ды — бинарные соединения бора с более электроположительными химическими элементами, в частности с металлами
Химические свойства:
· Бориды устойчивы к действию воды (кроме низших боридов Be и Mg), соляной, фтористоводородной и карбоновых кислот.
· Легко разлагаются окисляющими кислотами HNO3 и H2SO4 при нагревании.
· Взаимодействует с расплавами щелочей, карбонатов и сульфатов щелочных металлов.
· При окислении на воздухе образуют оксиды металла и бора, причем на поверхности боридов формируются пленки пироборатов, обладающие защитными свойствами.
· Бориды Ti и Zr устойчивы к действию расплавов металлов.
Получение:
· Взаимодействие металла с бором при нагревании.
· Восстановление оксида металла смесью бора и углерода, карбидом бора или бором при 1500—2000°С в вакууме.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
· Электролиз расплавов боратов и оксидов металлов.
· Взаимодействие металл- и борсодержащих соединений в условиях низкотемпературной плазмы.
· Монокристаллы боридов размером до 5 мм получают кристаллизацией из растворов бора и металлов в расплавах Al, Zn, крупные монокристаллы диаметром до 20 и длиной до 100 мм — методами зонной плавки или Вернейля.
· Покрытия из боридов на различных подложках получают методом осаждения из газовой фазы при взаимодействии галогенидов металлов и бора, плазменного напыления порошков и др.
Среди важнейших представителей боридов: диборид титана (применяется для изготовления испарителей для расплавов металлов и футеровки электролизеров, как компонент жаропрочных сплавов, инструментальных материалов, износостойких наплавочных покрытий (в основном в виде двойного борида (Ti, Cr)B2)); диборид циркония (применяется для изготовления защитных чехлов и элементов термопар (в паре с графитом), как нейтронопоглощающий материал для ядерных реакторов и компонент жаропрочных сплавов); диборид хрома (компонент износостойких наплавочных покрытий); гексаборид лантана (применяется в качестве эмиттеров в электроннолучевых устройствах средней и высокой мощности); гексаборид кальция (применяется как абразив, нейтронопоглощающий материал).
9. Оксид бора, борные кислоты, соли – получение, свойства, применение.
Бора оксид B2O3 - в природе в свободном состоянии не встречается.
Физические свойства:
Стекловидная гигроскопичная масса, растворяется в воде с образованием борной кислоты H3BO3:
B2O3 + 3H2O= 2H3BO3
Борная кислота H3BO3
Получение:
Встречается в природе, но может быть получена действием растворов кислот на тетраборат натрия:
Na2B4O7 + H2SO4 + 5H2O = 4H3BO3 + Na2SO4
Na2B4O7 + 2HCl + 5H2O = 4H3BO3 + 2NaCl
Физические свойства
Белый порошок, плохо растворяется в холодной воде, при нагревании растворимость повышается. При охлаждении кристаллизуется в виде без цветных чешуйчатых кристаллов, с характерным перламутровым блеском.
Химические свойства
Слабая кислота, она слабее угольной кислоты и сероводорода.
1. при нагревании теряет воду.
2H3BO3= B2O3 + 3H2O
Борная кислота не образует солей, отвечающих её ортоформе. Все известные соли являются производными её конденсированных форм – тетра- или метаборной кислот.
2. при действии едкого натра образует тетроборат натрия:
4H3BO3 + 2NaOH = Na2B4O7+ 7H2O
Na2B4O7 ∙ 10Н2О - бура.
3. Качественная реакция
Этиловый спирт и концентрированная серная кислота при взаимодействии с сухой борной кислотой или сухими боратами образует борноэтиловый эфир, который при горении дает пламя с ярко-зеленой окраской

Бораты (оксобораты), соли борных кислот: метаборной НВО2, ортоборной Н3ВО3 и не выделенных в свободном состоянии полиборных.
Бораты - бесцветные аморфные вещества или кристаллы. Для безводных боратов температуры плавления находятся в интервале от 500 до 2000 °С; наиболее высокоплавкие метабораты щелочных и орто- и метабораты щелочноземельных металлов. Большинство боратов при охлаждении их расплавов легко образует стекла.
Большинство солей – боратов – в воде нерастворимы, исключение составляют бораты s-элементов. Более других используется тетраборат натрия Na2B4O7. В большинстве своем бораты полимерны, выделяются из растворов в виде кристаллогидратов. Полимерных борных кислот из раствора выделить не удается, в связи с тем, что они легко гидратируются. Поэтому при действии кислот на полибораты обычно выделяется борная кислота (эта реакция используется для получения кислоты):
Na2B4O7 + H2SO4 + 5H2O = 4H3BO3 + Na2SO4
Безводные метабораты получают сплавлением оксида бора или борной кислоты с оксидами металлов:
CaO + B2O3 = Ca(BO2)2
Бораты используют: для получения других соединений бора; как компоненты шихты при производстве стекол, глазурей, эмалей, керамики; для огнестойких покрытий и пропиток; как компоненты флюсов для рафинирования, сварки и пайки металле”; в качестве пигментов и наполнителей лакокрасочных материалов; как протравы при крашении, ингибиторы коррозии, компоненты электролитов, люминофоров и др. Наибольшее применение находят бура и кальция бораты.
10. Галогениды, нитрид бора – строение молекул, свойства, получение. Боразон.
Галогениды бора известны для всех галогенов. Молекулы галогенидов имеют форму плоского треугольника с атомом бора в центре (sp2-гибридное состояние). В обычных условиях фторид BF3 – газ, BCl3 и BBr3 – жидкости, BI3 – твердое вещество. Все они бесцветны. Могут быть получены из простых веществ при нагревании. Фторид в промышленности получают нагреванием оксида бора с фторидом кальция в присутствии концентрированной серной кислоты:
B2O3 + 3CaF2 + 3H2SO4 = 2BF3 + 3CaSO4 + 3H2O
Получение хлорида основано на хлорировании раскаленной смеси оксида бора и угля:
B2O3 + 3C + 3Cl2 = 2BCl3 + 3CO
Галогениды бора, особенно фторид, сильнейшие акцепторы электронов (кислоты Льюиса), легко реагируют с донорами электронной пары:
BF3 + KF = KBF4; BF3 +: NH3 = F3B: NH3
тетрафтороборат калия
Кислотная природа галогенидов проявляется при их гидролизе, который протекает необратимо. Вследствие этого BCl3 и BBr3 на влажном воздухе дымят, а взаимодействие иодида бора с водой идет со взрывом.
BCl3 + 3H2O = H3BO3 + 3HCl
Нитрид бора — бинарное соединение бора и азота. Химическая формула: BN. Кристаллический нитрид бора изоэлектронен углероду и, подобно ему, существует в нескольких полиморфных модификациях.
Известны следующие аллотропные модификации нитрида бора:
· гексагональная (α), (белый графит — белый, похожий на тальк порошок, имеет гексагональную, графитоподобную кристаллическую структуру, температура плавления 3000 °C, полупроводник, применяется в качестве твёрдой высокотемпера-турной смазки);
· кубическая (β) - типа сфалерита, подобная алмазу: эльбор (боразон, кубонит, кингсонгит, плотность боразона 3, 51 г/см³.);
· плотная гексагональная (w), типа вюрцита, подобная лонсдейлиту.
Нитрид бора также может существовать в виде разнообразных аморфных модификаций, а также нанотрубок.




1)α -BN, гексагональный; 2)α -BN, гексагональный; 3)β -BN, структура типа сфалерита; 4)w-BN, структура типа вюрцита.
Свойства:
- Теплопроводность: 30 Вт/(м*К). Хорошо диспергируется в расплавах и пастообразных композициях. Твёрдость по Моосу чуть меньше 10.
- Нитрид бора не окисляется кислородом до ~700 °C, разрушается в горячих растворах щелочей с выделением аммиака. Со фтороводородом образует NH4[BF4], со фтором — BF3 и N2.
Кубический нитрид бора он же CBN, эльбор, кубонит, боразон применяется как высококачественный абразивный материал, по многим параметрам превосходящий алмаз: например, он не растворяется в железе при нагревании, что позволяет использовать его для высокопродуктивной обработки стали. Продукция с покрытием из нитрида бора востребована для черновой и финишной обработки деталей в первую очередь в таких отраслях как тяжелое машиностроение, автомобилестроение, добывающая промышленность, строительство. Также может применяться в качестве наполнителя, улучшающего теплопроводность, способного работать без смазки, в электроизоляционных материалах, в частности, в изоляции электрических машин.
11. Алюминий – получение, свойства, применение. Оксид, гидроксид, алюминаты, галогениды, строение их молекул, получение и свойства.
Алюми́ ний — элемент 13-й группы периодической таблицы химических элементов, третьего периода, с атомным номером 13. Обозначается символом Al (лат. Aluminium). Относится к группе лёгких металлов.
Простое вещество алюминий (CAS-номер: 7429-90-5) — лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке.
Получение.
Современный метод получения, процесс Холла—Эру был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии, и поэтому получил промышленное применение только в XX веке.
Лабораторный способ получения алюминия предложил Фридрих Вёлер в 1827 году восстановлением металлическим калием безводного хлорида алюминия (реакция протекает при нагревании без доступа воздуха):

Химические свойства.
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°), O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован в современной промышленности. Однако при разрушении оксидной плёнки, алюминий выступает как активный металл-восстановитель.
Алюминий образует сплавы почти со всеми металлами. Наиболее известны сплавы с медью и магнием (дюралюминий) и кремнием (силумин).
Применение:
· Благодаря комплексу свойств широко распространён в тепловом оборудовании.
· Алюминий и его сплавы не приобретают хрупкость при сверхнизких температурах. Благодаря этому он широко используется в криогенной технике.
· Высокий коэффициент отражения в сочетании с дешевизной и лёгкостью вакуумного напыления делает алюминий оптимальным материалом для изготовления зеркал.
· В производстве строительных материалов как газообразующий агент.
· Сульфид алюминия используется для производства сероводорода.
· Идут исследования по разработке пенистого алюминия как особо прочного и лёгкого материала.
· Как компонент термита, смесей для алюмотермии.
· В пиротехнике.
· Алюминий применяют для восстановления редких металлов из их оксидов или галогенидов.
Оксидалюминия представляет собой белую, очень тугоплавкую (т. пл. 2050 оС) и нерастворимую в воде массу. Природный Al2O3 (минерал корунд), а также полученный искусственно и затем сильно прокаленный отличается большой твердостью и нерастворимостью в кислотах. В растворимое состояние Al2O3 (т. н. глинозем) можно перевести сплавлением со щелочами.
Ввиду нерастворимости Al2O3 в воде, отвечающий этому оксиду гидроксид Al(OH)3 может быть получен лишь косвенным путем из солей. Получение гидроксида можно представить в виде следующей схемы. При действии щелочей ионами OH— постепенно замещаются в аквакомплексах [Al(OH2)6]3+ молекулы воды:
[Al(OH2)6]3+ + OH— = [Al(OH)(OH2)5]2+ + H2O
[Al(OH)(OH2)5]2+ + OH— = [Al(OH)2(OH2)4]+ + H2O
[Al(OH)2(OH2)4]+ + OH— = [Al(OH)3(OH2)3]0 + H2O
Al(OH)3 представляет собой объемистый студенистый осадок белого цвета, практически нерастворимый в воде, но легко растворяющийся в кислотах и сильных щелочах. Он имеет, следовательно, амфотерный характер. Однако и основные и особенно кислотные его свойства выражены довольно слабо. В избытке NH4OH гидроксид алюминия нерастворим. Одна из форм дегидратированного гидроксида — алюмогель используется в технике в качестве адсорбента.
При взаимодействии с сильными щелочами образуются соответствующие алюминаты:
NaOH + Al(OH)3 = Na[Al(OH)4]
Алюминаты наиболее активных одновалентных металлов в воде хорошо растворимы, но ввиду сильного гидролиза растворы их устойчивы лишь при наличии достаточного избытка щелочи. Алюминаты, производящиеся от более слабых оснований, гидролизованы в растворе практически нацело и поэтому могут быть получены только сухим путем (сплавлением Al2O3 с оксидами соответствующих металлов).
С кислотами Al(OH)3 образует соли. Производные большинства сильных кислот хорошо растворимы в воде, но довольно значительно гидролизованы, и поэтому растворы их показывают кислую реакцию. Еще сильнее гидролизованы растворимые соли алюминия из слабых кислот. Вследствие гидролиза сульфид, карбонат, цианид и некоторые другие соли алюминия из водных растворов получить не удается.
Галогениды алюминия в обычных условиях — бесцветные кристаллические вещества. В ряду галогенидов алюминия AlF3 сильно отличается по свойствам от своих аналогов. Он тугоплавок, мало растворяется в воде, химически неактивен. Основной способ получения AlF3 основан на действии безводного HF на Al2O3 или Al:
Al2O3 + 6HF = 2AlF3 + 3H2O
|
|
