
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
С электрофилами
|
|
Несмотря на низкую формальную степень окисления, карбонилы металлов относительно инертны к действию многих электрофилов. Например, они устойчивы к действию алкилирующих агентов, слабых кислот, мягких окислителей. Большинство карбонилов металлов подвергается галогенированию. Пентакарбонил железа, например, образует карбонильные галогениды:
Fe(CO)5 + X2 → Fe(CO)4X2 + CO
Галогены способны расщеплять связь металл-металл:
Mn2(CO)10 + Cl2 → 2 Mn(CO)5Cl
Общий способ получения карбонилов металлов заключается во взаимодействии окиси углерода с металлами или их солями при повышенных температурах и давлении. Наибольшее техническое значение имеют карбонилы никеля Ni(CO)4, кобальта Со(СО)4 и железа Fe(CO)3. Карбонилы применяют для получения чистых металлов, образующихся при их термическом разложении. Термическое разложение карбонилов кобальта, никеля и хрома используется для нанесения металлических покрытий, особенно на поверхности сложной формы. Карбонилы кобальта и никеля применяются в качестве катализаторов важных химических процессов. Их используют при синтезе карбоновых кислот и их производных из олефинов, акриловой кислоты из ацетилена, при гидроформилировании.
15. Диоксид углерода, угольная кислота и ее соли – строение молекулы, получение и свойства. Применение углерода и его соединений.
Диокси́ д углеро́ да (углеки́ слый газ, двуо́ кись углеро́ да, окси́ д углеро́ да (IV), у́ гольный ангидри́ д) — бесцветный газ, без запаха, со слегка кисловатым вкусом.
При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов.
Оксид углерода(IV) не поддерживает горения. В нём горят только некоторые активные металлы:

Взаимодействие с оксидом активного металла:
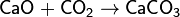
При растворении в воде образует угольную кислоту:

Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов:
 (качественная реакция на углекислый газ)
(качественная реакция на углекислый газ)

В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать СО₂, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами.
У́ гольная кислота́ — слабая двухосновная кислота с химической формулой H2CO3, образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. В водных растворах неустойчива. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Угольная кислота образуется при растворении в воде диоксида углерода:

Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом, бо́ льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:

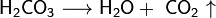
Химические свойства.
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
 , константа равновесия при 25С
, константа равновесия при 25С

В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе

Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево.
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
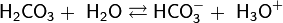 , константа кислотности при 25С
, константа кислотности при 25С

Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:

Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
 , константа кислотности при 25С
, константа кислотности при 25С

Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:

Значение pH в такой системе, соответствующей насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
 ,
,
где L = 0, 034 моль/л — растворимость CO2 в воде при указанных условиях.
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие смещается в сторону разложения угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
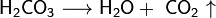
Будучи двухосновной, угольная кислота образует два ряда солей: средние соли (карбонаты) и кислые (гидрокарбонаты). Большинство солей угольной кислоты бесцветны. Из карбонатов растворимы в воде лишь соли щелочных металлов и аммония.
В воде карбонаты подвергаются гидролизу, и поэтому их растворы имеют щелочную реакцию:
Na2CO3 + H2O ↔ NaHCO3 + NaOH.
Дальнейший гидролиз с образованием угольной кислоты в обычных условиях практически не идет.
Растворение в воде гидрокарбонатов также сопровождается гидролизом, но в значительно меньшей степени, и среда создается слабощелочная (рН ≈ 8).
Сильные кислоты и даже слабая уксусная кислота вытесняют из карбонатов угольную кислоту:
K2CO3 + H2SO4 = K2SO4 + H2O + CO2↑.
В отличие от большинства карбонатов, все гидрокарбонаты в воде растворимы. Они менее устойчивы, чем карбонаты тех же металлов и при нагревании легко разлагаются, превращаясь в соответствующие карбонаты:
2KHCO3 = K2CO3 + H2O + CO2↑;
Ca(HCO3)2 = CaCO3 + H2O + CO2↑.
Сильными кислотами гидрокарбонаты разлагаются, как и карбонаты:
KHCO3 + H2SO4 = KHSO4 + H2O + CO2
Основные соли угольной кислоты в воде практически нерастворимы и при нагревании легко разлагаются:
(CuOH)2CO3 = 2CuO + CO2 + H2O.
|
|
