
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Дать общую характеристику метода хроматометрии. Указать рабочие растворы, индикаторы, область применения, уравнения реакций, расчетные формулы.
|
|
Ответ
2.1. Хроматометрией называют метод объемного анализа, основанный на использовании в качестве стандартного водного раствора бихромата калия или (реже) хромата калия. Иногда вместо указанных реагентов применяют трехокись хрома (хромовый ангидрид), который растворяют в ледяной уксусной или концентрированной серной кислоте. Обычно титрование проводят в сернокислой, солянокислой или фосфорнокислой средах. Применение хроматометрического метода основано на реакциях: окисления—восстановления) и реакциях двойного обмена, сопровождающихся образованием нерастворимых в воде соединений.
2.2. Рабочим раствором хроматометрии является раствор дихромата калия K2Cr2O7. Кристаллический препарат K2Cr2O7 легко приготовить достаточно чистым, он устойчив при хранении на воздухе, поэтому титрованные растворы дихромата калия готовят по точной навеске кристаллической соли. Раствор дихромата калия сохраняет неизменный титр длительное, неопределенно долгое время, его можно кипятить без разложения. Недостатком реактива является образование в результате реакции окрашенных ионов Cr3+, затрудняющих своей окраской фиксирование точки эквивалентности.
2.3. Примененяются ред-окс- индикаторы (дифениламин, дифениламинсульфокислота, фенилан-траниловая кислота), хемилюминесцентных индикаторов, а также индикаторы, например AgNO3, K3[Fe(CN)6], образующие окрашенные осадки с избытком титранта, или индикацию проводят по появлению окраски ионов Cr(VI). Последний способ является наименеее точным.
2.4. Область применения: хроматометриюприменяют для определения Fe(II), Te(IV), W(III), Mo(III), Sn(II), Ti(III), V(IV), SO32-, Fe(CN)64-, органических веществ (гидрохинона, аскорбиновой кислоты и др.). также для определения необратимо восстанавливающихся окислителей (напр., хлоратов. нитратов), которые предварительно восстанавливают известным объемом стандартного раствора Fe(II). Избыток Fe(II) оттитровывают дихроматом с индикаторами дифениламином, дифениламиносульфокислотой (в присут. Н3РО4) или N-фенилантраниловой кислотой.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
2.5. Основные реакции, протекающие с участием бихромата и используемые в объемном анализе:
Окисление гексацианоферрата (II):
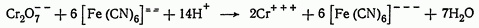
Окисление ванадия (IV):

Окисление метилового спирта:

Окисление гидрохинона:

Окисление ионов церия (III):

|
|
