
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Решение. 1.Состав и природа компонентов:
|
|
1.Состав и природа компонентов:
А)NН4ОН (NН3 х Н2О)-гидроксид аммония, слабый электролит
Б) NН4С1 – соль, хлорид аммония, сильный электролит.
Гидроксид аммония - слабый электролит, в растворе частично диссоциирует на ионы:
NН4ОН < => NН4+ + ОН-
При добавлении к раствору гидроксида аммония хлорида аммония, соль как сильный электролит практически полностью диссоциирует на ионы:
NН4С1 > NН4+ + С1-
и подавляет диссоциацию основания, равновесие которого смещается в сторону обратной реакции.
1. Интервал значений рН, внутри которого рассматриваемая система обладает буферной емкостью, рассчитывается по формуле:
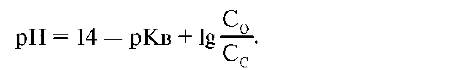 ,
,
где Кв – константа диссоциации NН4ОН=1, 8*10-5, С0-концентрация основания, Сс-концентрация соли.
рН=14-4, 74+lg(C0/Cc)=9, 26+lg(C0/Cc). В зависимости от соотношения C0/Cc интервал значений рН составляет 8, 26-10, 26.
2. Способность аммиачного буфера поддерживать практически постоянное значение рН раствора основана на том, что входящие в них компоненты связывают ионы Н+ и ОН-, вводимые в раствор или образующиеся в результате реакции, протекающей в этом растворе. При добавлении к аммиачной буферной смеси сильной кислоты, ионы Н+ будут связываться молекулами или гидроксида аммония, а не увеличивать концентрацию ионов Н+ и уменьшать рН раствора:
NH4OH+H+=NH4++H2O
При добавлении щелочи ионы ОН - будут связывать ионы NН4+, образуя при этом малодиссоциированное соединение, а не увеличивать рН раствора:
NH4++ОН-= NH4OH
3. Аммиачная буферная система не входит в состав крови, поскольку интервал значений рН, внутри которого она будет обладать буферной емкостью, находится в щелочной области (рН больше 8). Нормальное значение рН плазмы крови составляет 7, 40 ± 0, 05, т.е ниже области буферирования.
15.В 200 мл фосфатного буферного раствора содержится 0, 8 моль кислотного компонента (Н2РО4-) и 1, 6 моль солевого компонента (НРО42–). Установите рН буферного раствора. Объясните, входит ли рассчитанное значение рН в ЗБД (рН: 6, 2 – 8, 2).Ки (Н2РО4-) = 6, 2× 10-8 моль/л; lg 2 = 0, 3; lg 6, 2 = 0, 79. Классифицируйте буферную систему по составу и природе компонентов.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
|
|
