
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Равенство скоростей прямой и обратной реакций является кинетическим условием химического равновесия.
|
|
Истинное химическое равновесие устанавливается только в закрытых системах и характеризуется следующими основными особенностями:
Термодинамической устойчивостью – постоянством во времени равновесного составасистемы при отсутствии или неизменности внешних воздействий (температуры, давления или концентраций веществ, участвующих в образовании системы).
Подвижностью – способностью положения равновесия легко смещаться в ту или иную сторону при наличии внешних воздействий, сколь малы бы они не были. Смещением положения равновесия называют изменение состояния равновесия в результате изменения условий, т.е. переход системы из одного равновесного состояния в другое в соответствии с принципом Ле Шателье – Брауна:
Если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то в системе происходит смещение равновесия в направлении процесса, усиленное протекание которого ослабляет оказываемое воздействие.
Динамическим характером, означающим непрерывное протекание с одинаковой скоростью как прямой, так и обратной реакции, при этом результирующая скорость обратимой реакции становится равной нулю.
Для прямой и обратной реакций можно применить кинетическое выражение закона действующих масс: скорость элементарной химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам.
При наступлении химического равновесия в системе, когда скорость прямой реакции равна скорости обратной реакции и закон действующих масс формулируется следующим образом: отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции, взятых в степенях их стехиометрических коэффициентов, к произведению для исходных веществ есть величина постоянная. Этот параметр называемая константой равновесия К равн.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Для обратимой гомогенной реакции:
ν AA + ν BB у ν DD + ν F F
константа равновесия может быть выражена в виде отношения равновесных молярных концентраций реагирующих веществ - K C, равновесных парциальных давлений – K P, равновесных молярных долей - K X:
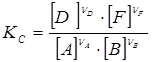 ;
;  ;
; 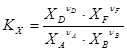 (1)
(1)
Между константами равновесия KC, KP и KX для реакции с участием идеальных газов легко установить взаимосвязь, используя уравнение Менделеева – Клапейрона (pV=nRT) и закон Дальтона (pi = Xi p0, где pi – парциальное давление i-ого газа, p0 – общее давление в системе, Xi – молярная доля i-ого газа):
KP = KC(RT)Δ ν и KP = KX (p0)Δ ν (2),
где Δ ν = (ν D + ν F) – (ν A + ν B)
Константы KP, KC и KX называются эмпирическими константами равновесия, они могут быть численно равны, если Δ ν = 0, и иметь размерность, если Δ ν ≠ 0.
Термодинамическая константа равновесия K0 безразмерна и может быть вычислена из стандартной энергии Гиббса:
Δ r G0T = - RT ln K0 (3)
Контрольные вопросы и задачи для предварительной подготовки лабораторной работы
1. Сформулируйте определение обратимой и необратимой реакций.
2. Что называют химическим равновесием? Почему оно называется динамическим? Какие концентрации реагирующих веществ называют равновесными?
3. Что называют константой химического равновесия? Зависит ли она от природы реагирующих веществ, их концентрации, температуры, давления?
4. Как можно управлять химическим равновесием? Какие факторы влияют на смещение химического равновесия?
5. Если константа скорости прямой реакции много меньше или много больше константы скорости обратной реакции, как это влияет на числовое значение константы равновесия и выход продуктов реакции?
6. Напишите выражение для констант равновесия следующих обратимых гомогенных химических реакций:
а) H2 + Cl2 у 2 HCl;
б) CO + Cl2 у COCl2;
в) N2 + 3 H2 у 2 NH3;
г) 2 CO + O2 у 2 CO2.
|
|
