
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Электрическая проводимость растворов электролитов
|
|
В растворах электролитов сольватированные ионы находятся в беспорядочном тепловом движении. При наложении электрического поля возникает упорядоченное движение ионов к противоположно заряженным электродам, т.е. электрический ток. Мерой способности вещества проводить электрический ток является электрическая проводимость (электропроводность) L - величина, обратная электрическому сопротивлению R. Так как R = r 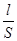 , где r - удельное сопротивление, Ом× м; S - площадь поперечного сечения, м2; l - длина проводника, м; то
, где r - удельное сопротивление, Ом× м; S - площадь поперечного сечения, м2; l - длина проводника, м; то
L = 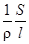 =
= 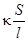
Величина, обратная удельному сопротивлению, называется удельной электрической проводимостью k. Это электрическая проводимость раствора электролита, заключенного между двумя параллельными электродами, имеющими площадь по 1 м2 и расположенными на расстоянии 1 м друг от друга (Ом-1м-1 или См/м).
Удельная электропроводность меняется с изменением концентрации растворов. В растворах слабых электролитов значительно ниже, чем у растворов сильных электролитов той же концентрации. Это обусловлено небольшой степенью диссоциации слабого электролита. При повышении его концентрации одновременно увеличивается число молекул, способных диссоциировать, но снижается степень диссоциации.
Контрольные вопросы и задачи для предварительной подготовки лабораторной работы
1. Какие вещества называют электролитами? По какому принципу их разделяют на сильные и слабые электролиты?
2. Напишите уравнения электролитической диссоциации известных вам сильных кислот и оснований в водных растворах.
3. Что служит количественными характеристиками процесса электролитической диссоциации?
4. Напишите выражение концентрационной константы диссоциации для угольной кислоты Н2СО3 по первой и второй ступеням.
5. Для каких электролитов концентрационная константа диссоциации не имеет физического смысла?
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
6. Что зависит от концентрации раствора: константа диссоциации или степень диссоциации?
7. Напишите выражение закона разбавления Оствальда для бинарного электролита. Для каких электролитов можно использовать его упрощенную форму?
8. Что такое ионное произведение воды, водородный и гидроксидный показатели? Укажите значения этих величин при температуре 298 К в чистой воде.
9. Что такое произведение растворимости ПР? Напишите выражение ПР для Cu(OH)2 и Al(OH)3.
10. Что такое гидролиз, чем он отличается от электролитической диссоциации?
11. Какие четыре основных случая взаимодействия соли с водой вам известны?
12. Приведите примеры трех случаев гидролиза, напишите молекулярные и сокращенные ионно-молекулярные уравнения гидролиза, укажите реакцию среды в каждом из этих случаев.
13. Что является мерой способности вещества проводить электрический ток?
|
|
