
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Растворы электролитов
|
|
Электролиты - вещества, растворы которых проводят электрический ток, так как в растворах электролитов имеются подвижные заряженные частицы (ионы). К электролитам относятся вещества с ковалентной полярной или ионной связью.
Электролитическая диссоциация - процесс распада вещества на ионы при растворении в полярном растворителе. Основные положения теории электролитов описываются теорией электролитической диссоциации Аррениуса:
Степень электролитической диссоциации (a) - количественная характеристика диссоциации:
a = 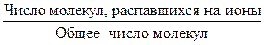 .
.
Сильные электролиты - степень диссоциации больше 30% и почти не зависит от концентрации раствора (растворы большинства солей, щелочей и некоторых кислот).
Слабые электролиты - степень диссоциации меньше 3% и уменьшается с ростом концентрации раствора (вода, ряд кислот, основания p-, d- b f- элементов).
Константа диссоциации (Кд) - константа равновесия для обратимого процесса диссоциации слабого электролита.
В растворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации - ионами. Например, для реакции диссоциации уксусной кислоты в водном растворе устанавливается равновесие:
CH3COOH D CH3COO- + H+,
которое количественно характеризуется константой равновесия (в этом случае ее называют константой диссоциации - Кд):
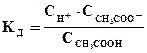 (8.5)
(8.5)
Так как 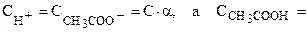 (1 - a)·С (С - концентрация), то Кд =
(1 - a)·С (С - концентрация), то Кд = 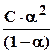 (а) и при a < < 1
(а) и при a < < 1 
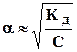 (б). (8.6)
(б). (8.6) 
Выражение (8.6) - закон разбавления Оствальда для слабых электролитов, молекулы которых диссоциируют на 2 иона. При большем числе ионов выражение усложняется. Так, для электролита состава KnAm:
KnAm = nKm+ + mAn-, 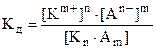 ;
;
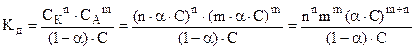 .
.
Для слабых электролитов (1-a)» 1 и 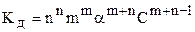 ;
;
a 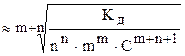 . (8.7)
. (8.7)
Экспериментально определяемые для сильных электролитов степени диссоциации называют кажущимися (aкаж). Как правило, aкаж не равна 100 % (или 1), что связано с объединением части ионов в нестойкие ионные пары или агрегаты ионов. Из закона разбавления следует, что a увеличивается с уменьшением концентрации.
Пример 5. Константа диссоциации азотистой кислоты равна 7·10–4. Концентрация раствора 0, 1 М. Вычислить степень диссоциации кислоты (%).
Решение. Из (7.6): с 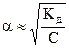 =
= 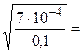 8, 37·10-2.
8, 37·10-2.
|
|
