
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Свойства разбавленных растворов электролитов
|
|
Коллигативные свойства (DP, DТкип, DТзам, Pосм) для растворов электролитов всегда больше рассчитываемых по формулам (8.1 – 8.4), т.к. в этих растворах на самом деле больше частиц (ионов и молекул), чем растворено молекул. Это обстоятельство учитывается с помощью изотонического коэффициента (i), который показывает, во сколько раз увеличилось общее число частиц в растворе в результате частичной или полной диссоциации на ионы.
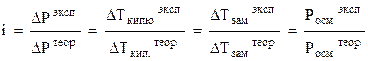 (8.8)
(8.8) 
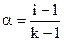 . (8.9)
. (8.9)
Здесь k – максимальное число ионов, на которые может распадаться формульная единица или молекула. Очевидно, что 1 < i < k.
[концентрация ионов] = СМ·α (8.10)
Тогда коллигативные свойства для растворов электролитов будут определяться по формулам:
DР = i · Р1º χ; DТкип = i× КэCm;
DТзам = i× KкCm; Pосм = i× CRT. (8.11)
Пример 8. Вычислить осмотическое давление (при 17 oС) раствора Na2SO4, в 1л которого содержится 7, 1 г растворенной соли. Кажущаяся степень диссоциации (aкаж) соли в растворе составляет 0, 69 (69 %).
Решение. Производим вычисление Росм исходя из предположения, что никакой диссоциации в растворе нет. В этом случае согласно закону Вант-Гоффа (8.4):
Росм = CМ·R·T = 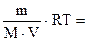
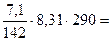 120, 5 кПа.
120, 5 кПа.
Полученное значение следует увеличить в i раз, так как растворенное вещество является электролитом. Коэффициент i можно вычислить по приведенной выше формуле (8.9), т.е. a× (k - 1) = (i - 1), k = 3. (Na2SO4 = 2Na+ + SO42-,)
Отсюда i = 2a + 1 = 2·0, 69 + 1 = 2, 38. Росм.(Na2SO4) = 2, 38× 120, 5 = 286, 8 кПа.
Пример 9. Моляльность раствора нитрата железа (III) 2 моль/кг Н2О. Степень диссоциации соли в растворе 100 % при 25 °С. КЭ воды 0, 516 К/моль.
Чему равен изотонический коэффициент раствора и при какой температуре начнет кипеть раствор?
Решение. Раствор Fe(NO3)3 является сильным электролитам:
Fe(NO3)3 = Fe3+ + 3NO3-, т.е. из каждого моля получается 4 моля ионов, поэтому, со-
гласно выражению (8.9), i = 4. Определим DТкиппо формуле (8.11):
DТкип = i× КэCm = 4·0, 516·2 = 4, 13. Ткип = 100 + 4, 13 = 104, 13 оС.
|
|
