
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Водородный показатель
|
|
Ионное произведение воды. Особая роль воды в химии определяется, в частности, тем, что она широко используется для приготовления растворов и как среда для проведения реакций. Поэтому важное значение имеет собственная диссоциация воды на ионы: Н2О ⇆ Н+ + ОН-.
Константа равновесия этой обратимой реакции называется константой диссоциации (Кд): Кд = 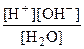 .
.
Так как [H2O] - величина постоянная ([H2O] = 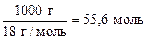 ), и мало отличающаяся от концентрации всех (диссоциировавших и недиссоциировав ших) молекул воды, ее включают в константу, которую называют ионным произведением воды (Кв):
), и мало отличающаяся от концентрации всех (диссоциировавших и недиссоциировав ших) молекул воды, ее включают в константу, которую называют ионным произведением воды (Кв):
Kд·[H2O] = [H+]·[OH-] = Кв, (8.11)
то есть Кд = Кв/55, 6.
ИП не зависит от концентраций ионов - если концентрация одного из них увеличивается, то другого - уменьшается так, что ИП остается неизменным. При 295К ионное произведение воды равно 10-14. Отсюда
[H+] = [OH-] = 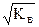 = 10-7 моль/л.
= 10-7 моль/л.
Ионное произведение, как и всякую константу равновесия, можно найти по термодинамическим данным (DG0дисс.):
Кд = exp (-DG0 дисс / RT). (8.12)
Пример 13. Какова концентрация ОН--ионов в 0, 01 М растворе НCl?.
Решение. В 0, 01 М растворе сильного электролита HCl содержится 0, 01 моль/л ионов Н+. Используя выражение (8.11), получаем:
0, 01.[ОН-] = 10-14; отсюда [ОН-] = 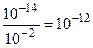 (моль/л).
(моль/л).
Водородный показатель рН. В соответствии с теорией электролитической диссоциации, ионы H+ являются носителями кислотных свойств, а ионы OH- - основных. Кислотность или щелочность водных растворов может быть охарактеризована концентрацией ионов [Н+] или [ОН-]. Для удобства вместо концентраций используют их отрицательные логарифмы:
рН = - lg [H+] и pOH = - lg [OH-]. (8.13)
Для чистой воды [Н+] = [ОН-] = 10-7 и рН = рОН = 7. Это нейтральная среда и нейтральные растворы. Если в растворе [Н+] > [ОН-], то рН < 7, а рОН > 7 - это кислые растворы; в случае если [Н+] < [ОН-], то рН > 7, а
рОН < 7 - это щелочные растворы. Очевидно, что
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
pН + pOH = 14. (8.14)
Таким образом, можно сказать, что в шкале рН от 0 до 7 - кислые растворы, а от 7 до 14 - щелочные.
Таблица 8.1.
|
|
