
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Способы выражения концентрации растворов
|
|
Важнейшей характеристикой всякого раствора является концентрация. Концентрацией называется содержание растворенного вещества в единице массы или объема раствора или растворителя. В химии используется несколько различных способов выражения концентрации. Кратко рассмотрим наиболее часто употребляемые.
Массовая доля (процентная концентрация) (ω) - отношение массы растворенного вещества к общей массе раствора (выражается в процентах или в долях единицы):
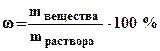 , (7.1)
, (7.1)
mр-ра = V r, (7.2)
где V – объем раствора (мл); r - плотность раствора (г/мл).
Например: имеется раствор какого-либо вещества с массовой долей 5 %. Это значит, что 5 % от общей массы раствора приходится на растворенное вещество, и 95 % - на растворитель. Массовая доля вещества составляет 0, 05.
Пример 1. В 450 г воды растворили 50 г вещества. Найти массовую долю вещества в растворе.
Решение. Общая масса раствора составляет 500 г (450 + 50).
По формуле (7.1): 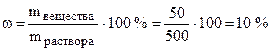 .
.
Пример 2. Сколько г Na2SO3 потребуется для приготовления 5 л раствора с массовой долей 8% (r = 1, 075 г/мл)?
Решение. Находим массу раствора: m = V·r = 5000 мл·1, 075 г/мл = 5375 г.
Отсюда:
5375 г раствора - 100 %
x г вещества - 8 % x = (8·5375)/100 = 430 г Na2SO3.
Пример 3. Сколько литров газообразного хлороводорода (н.у.) нужно растворить в 250 г воды для получения 20% -й соляной кислоты?
Решение. 20 %-й раствор - это 20 г хлороводорода и 80 г воды. Составляем пропорцию:
20 г HCl - 80 г H2O
X г - 250 г. Отсюда X = 62, 5 г HCl.
Найдем объем HCl (н.у.), учитывая, что 1 моль HCl (т.е. 36, 5 г) при этих условиях занимает объем 22, 4 литра:
36, 5 г HCl - 22, 4 л
62, 5 г - X л X = 38, 4 л.
Пример 4. Из 500 г 10%-го раствора Na2SO4 выпариванием удалено 150 мл воды и получен раствор с плотностью 1, 13 г/мл. Для полученного раствора укажите: массовую долю сульфата натрия (в %)/
Решение. Чтобы найти массовую долю вещества необходимо, согласно формуле 7.1, найти массу вещества и массу раствора. Масса вещества составляет 10% от массы раствора, т.е. 500·0, 1 = 50 г. Масса раствора после выпаривания 150 мл воды стала равна 350 г.
Таким образом: 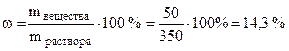 .
.
Молярная концентрация или моляльность (СМ или М) - число молей растворенного вещества в 1 литре раствора (моль/л)
CM = 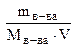 ) (7.3)
) (7.3)
Пример 5. Сколько граммов KOH содержится в 500 мл 5 М раствора?
Решение. 5 М раствор - это 5 моль KOH в 1 л раствора. М KOH = 56 г/моль. Составляем пропорцию:
1л раствора - 5× 56 г вещества
0, 5л - x г x = 0, 5× 5× 56 = 140 г KOH.
Молярная концентрация эквивалентов или нормальная (Н) (СЭК) - количество (моль) эквивалентов растворенного вещества в 1 л раствора (моль экв/л)
Cэк = 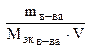 (7.4)
(7.4)
Пример 6. Сколько граммов сульфата алюминия нужно взять для приготовления
200 мл раствора с эквивалентной концентрацией 0, 5 моль·экв?
Решение. 0, 5 Н раствор - это значит, что в 1 литре раствора содержится 0, 5 моль эквивалента вещества.
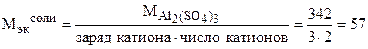 г/моль.
г/моль.
Составим пропорцию: 1 л раствора - 0, 5·57 г
0, 2 л - х г, х = 0, 2× 0, 5× 57 = 5, 7 г Al2(SO4)3.
Титр (Т) - масса растворенного вещества в 1 мл раствора (г/мл).
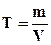 . (7.5)
. (7.5)
Зная нормальность раствора, титр можно рассчитать по формуле
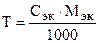 . (7.6)
. (7.6)
Моляльная концентрация или моляльность (Сm) - количество (моль) растворенного вещества в 1000 г чистого растворителя (моль/кг).
Сm = 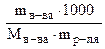 моль/кг растворителя. (7.7)
моль/кг растворителя. (7.7)
Пример 7. Вычислите молярную, эквивалентную концентрацию, моляльность и титр раствора H2SO4 с массовой долей кислоты 15 % (r = 1, 1 г/мл).
Решение. Чтобы найти молярную и эквивалентную концентрацию раствора, надо найти, сколько вещества растворено в 1 л раствора. По уравнению (7.2):
m (1л) = V·r = 1000·1, 1= 1100 г
1100 г раствора - 100 %
х г - 15 % х = (1100·15) / 100 = 165 г (H2SO4).
М(H2SO4) = 98 г/моль; Мэк(H2SO4) 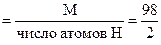 = 49 г/моль экв.
= 49 г/моль экв.
Следовательно, CМ = m / M = 165 / 98 = 1, 68 моль/л (по 7.3).
Сэк = m / Mэк = 165 / 49 = 3, 37 моль экв/л (7.4). Т = m/V = 165 / 1000 = 0, 165 г/мл.
Для нахождения моляльной концентрации используем выражение 7.7.
Сm = 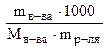 =
= 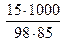 = 1, 8 (моль/кг).
= 1, 8 (моль/кг).
Пример 8. Для нейтрализации 42 мл H2SO4 потребовалось добавить 14 мл 0, 3 Н раствора щелочи. Определить молярность раствора H2SO4.
Решение. Поскольку согласно закону эквивалентов вещества взаимодействуют в эквивалентных количествах, то можно использовать следующее равенство:
СН1·V1 = СН2·V2 (где СН1 и СН2 - эквивалентные концентрации растворов, а V1 и V2 - объемы). Следовательно,
Сэк к-ты·42 = 0, 3·14; отсюда Сэк к-ты = (0, 3·0, 14) / 42 = 0, 1 Н.
Поскольку Мэк (H2SO4) = М/2, т.е. 0, 5 моль, то (СМ) кислоты составляет 0, 1·0, 5 =
0, 05 моль/л.
Мольная доля (NA) - отношение количества вещества одного растворенного компонента раствора к общему количеству всех компонентов.
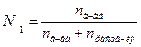 ;. (7.8)
;. (7.8)
 Например, для 8%-го раствора Na2SO4 (М = 142 г/моль):
Например, для 8%-го раствора Na2SO4 (М = 142 г/моль):
NA = 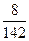 :
: 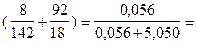 0, 011.
0, 011.
Пример 9. В 500 г воды растворено при нагревании 300 г хлорида аммония. Какая масса NH4Cl выделится из раствора при охлаждении его до 50 0С, если коэффициент растворимости соли при этой температуре равен 50?
Решение. Растворимость вещества измеряется концентрацией его насыщенного раствора. Обычно растворимость твердых веществ и жидкостей выражают значением коэффициента растворимости, т. е. массой вещества, растворяющегося при данных условиях в 100 г растворителя с образованием насыщенного раствора.
Рассчитаем, сколько соли может раствориться при данной температуре в 500 г воды с учетом коэффициента растворимости:
в 100 г воды растворяется 50 г соли
500 г ¾ Х г, Х = 250 г.
Следовательно, это предельная растворимость вещества при данной температуре, остальное, т.е. (300 – 250) = 50 г при охлаждении раствора выпадет в осадок.
Пример 10. При 60 °С насыщенный раствор KNO3 содержит 52, 4 % соли. Найти коэффициент растворимости соли при этой температуре.
Решение. Коэффициент растворимости находим из пропорции:
На 47, 6 г Н2О приходится 52, 4 г KNO3
На 100 г Н2О — х г Отсюда: х = 110 г.
Таким образом, растворимость KNO3 при 60 °С равна 110 г в 100 г воды.
Пример 13. При охлаждении 300 г 15 % раствора часть растворенного вещества выпала в осадок и концентрация раствора стала равной 8 %. Чему равна масса выпавшего в осадок вещества?
Решение. В 300 г 15 % раствора содержится 45 г вещества (300∙ 0, 15 = 45).и 255 г растворителя (300 – 45). При охлаждении количество растворителя не изменилось. Содержание растворенного вещества в 255 г растворителя находим из пропорции:
92 г растворителя содержат 8 г вещества (всего 100 г раствора)
255 г х г Отсюда х = 22, 2 г.
Таким образом, при охлаждении раствора в осадок выпало 22, 8 г вещества (45 – 22, 2).
|
|
