
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Диссоциация кислот, оснований и солей
|
|
В соответствии с теорией электролитической диссоциации Аррениуса кислоты в водных растворах диссоциируют на ионы Н+ и соответствующие анионы; основания - на ионы ОН 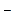 и катионы; соли - на анионы и катионы.
и катионы; соли - на анионы и катионы.
Диссоциация многоосновных кислот и многокислотных оснований происходит ступенчато, причем константа и степень диссоциации в каждой ступени обычно уменьшаются на 3¸ 7 порядков, так что часто можно учитывать лишь диссоциацию по 1-й ступени:
1. H3PO4 ⇆ H2PO4- + H+ К1 = 7, 4× 10-3;
2. H2PO4- ⇆ НPO42- + H+ К2 = 6, 3× 10-8;
3. НPO42- ⇆ PO43- + H+ К3 = 4, 4× 10-13.
Пример 6. Расположите ионы 1) H+, 2) HPO42–, 3) PO43–, 4) H2PO4–, образующиеся при диссоциации ортофосфорной кислоты в порядке увеличения их концентрации. Какой из этих ионов имеет наименьшую концентрацию?
Решение. Исходя из констант диссоциации кислоты (они приведены выше), видно, что преобладающее значение имеет диссоциация по 1-ой ступени, а, следовательно, и концентрации ионов будут больше. Таким образом, ответом будет следующее расположение: 3241. Наименьшую концентрацию имеет ион под номером 3.
Растворимые средние соли (Na2CO3, NaCl, K2SO4 и др.) - обычно сильные электролиты и диссоциируют в воде нацело в одну ступень независимо от состава. Например:
Na2CO3 = 2Na+ + CO32-.
Кислые и основные соли диссоциируют ступенчато:
1. NaHCO3 = Na+ + HCO3-, 2. HCO3- ⇆ H+ + CO32-.
Основные соли: 1. MgOHCl = MgOH+ + Cl-, 2. MgOH+ ⇆ Mg2+ + OH-.
Пример 7. Сколько моль катионов и анионов содержится в 3-х л 0, 5 М раствора сульфата алюминия?
Решение. В растворе соль диссоциирует по уравнению: Al2(SO4)3 = 2Al3+ + 3SO42-.
Из уравнения следует, что из каждого моля сульфата алюминия получается 2 моль катионов алюминия и 3 моль анионов 3SO42-. В растворе содержится 1, 5 моль соли (0, 5 М раствор содержит 0, 5 моль в литре раствора, а в 3-х литрах - 1, 5). Таким образом, из 1, 5 моль при диссоциации получится 3 моль катионов и 4, 5 моль анионов.
|
|