
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Принцип Ле Шателье
|
|
Химическое равновесие, отвечающее минимуму энергии Гиббса
(DG = 0), является наиболее устойчивым состоянием системы при данных условиях. Изменение условий равновесия может его нарушить, в результате чего реакция начинает протекать в прямом или обратном направлении (при этом говорят, что равновесие смещается в сторону прямой или обратной реакции). Через некоторое время система вновь становится равновесной с новыми равновесными концентрациями всех реагирующих веществ. Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, подействовать извне, то равновесие смещается в том направлении, которое ослабляет это воздействие. Проиллюстрируем принцип смещения равновесия на следующих примерах.
Пример 7. В каком направлении должно смещаться равновесие реакции
N2O4 (г) ⇆ 2NO2 (г), DH° = 58, 0 кДж
при а) добавлении N2O4; б) удалении NO2; в) повышении давления; г) увеличении температуры?
Решение. Согласно принципу Ле Шателье:
а) при добавлении N2O4 равновесие должно сместиться в направлении реакции, в результате которой концентрация этого вещества должна уменьшиться, т.е. в сторону прямой реакции (®);
б) при удалении NO2 из системы равновесие будет смещаться в направлении того процесса, в результате которого образуется дополнительное количество NO2 (вправо ®);
в) при повышении давления равновесие смещается в направлении процесса, идущего с уменьшением объема (уменьшения числа молекул газа), т.е. в сторону обратного процесса (←);
г) при повышении температуры равновесие смещается в направлении реакции, идущей с поглощением теплоты (эндотермической, DH > 0), т.е. вправо (®).
Пример 8. Определите, как изменится константа равновесия рассматриваемой реакции при изменении температуры:
N2 + 3H2 ⇆ 2NH3, DHох.р. = -92, 4 кДж.
Решение. Процесс синтеза аммиака является экзотермическим (DHO< 0). Следовательно, согласно принципу Ле Шателье, при повышении температуры равновесие сместится в сторону реакции, идущей с поглощением теплоты, обратной реакции, т. е. в сторону образования дополнительных количеств реагентов (N2, H2). При этом К уменьшается. При понижении температуры К увеличивается, а равновесие смещается в направлении роста концентрации аммиака.
Пример 9. Для обратимой реакции
3CuO(т) + 2NH3(г) ⇆ 3Cu(т) + N2(г) + 3H2O(г); ∆ Hо = –240 кДж,
запишите математическое выражение константы равновесия и перечислите факторы, приводящие к смещению равновесия вправо.
Решение. Согласно выражению 5.1: 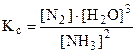 .
.
Напоминаем, что в выражение константы равновесия гетерогенной реакции входят только концентрации газообразных веществ, так как концентрации твердых веществ остаются, как правило, постоянными.
1. Протекание реакции вправо приводит к увеличению общего числа молей газов, поэтому, согласно принципу Ле Шателье, давление надо понизить.
2. Так как прямая реакция протекает с выделением теплоты (∆ Hº < 0), то температуру надо понижать.
3. Можно увеличить концентрацию NH3 или уменьшить концентрации N2 и H2O.
|
|
