
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Например, для обратимой реакции
|
|
аА + bВ ⇆ сС + dD
закон действующих масс имеет вид
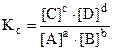 (5.1).
(5.1).
или, если вещества – газы,
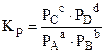 , (5.2)
, (5.2)
где [A], [В] и т. д. – равновесные концентрации веществ (моль/л);
РА, РВ и т.д... – парциальные давления газов.
Например, для реакции 2СН4 (г) ⇆ С2Н2 (г) + 3Н2 (г)
закон действующих масс запишется:
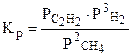 или
или 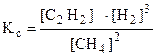 .
.
Если все реагенты газообразные и их поведение подчиняется законам идеальных газов, то связь между КР и КС можно выразить уравнением:
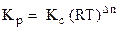 , (5.3)
, (5.3)
где Δ n - изменение числа молей газов в результате реакции; так что для рассматриваемой реакции Δ n = (1 + 3) - 2 = 2 и 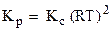 .
.
Константа равновесия обладает тем свойством, что она не зависит от концентрации реагентов и продуктов. В то же время константа равновесия зависит от температуры, – с увеличением температуры она увеличивается для эндотермических и уменьшается для экзотермических реакций.
В выражение ЗДМ включаются только концентрации растворов, концентрации или давления газов; конденсированные вещества в собственной фазе (Н2Ож, КСlт и т.п.) в формулу не включаются. Например, для реакции
Fe2O3 (т) + 3H2 (г) = 2Fe (т) + 3H2O (ж) ; 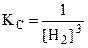 .
.
Так как Fe2O3 , Fe и H2O - конденсированные вещества, то равновесие реакции зависит только от концентрации Н2.
Константа равновесия - важнейшая термодинамическая характеристика реакции. По величине константы равновесия (К) можно судить о степени протекания реакции. При очень большом значении К равновесие реакции сильно сдвинуто вправо (в сторону продуктов), а при очень низком значении К реакция протекает в очень незначительной степени и равновесная смесь содержит преимущественно реагенты. Кроме того, по величине К можно вычислять концентрации реагентов и продуктов при достижении равновесия и, как будет показано ниже, DG реакции.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Пример 1. В системе CO + Cl2 ⇆ COCl2 равновесные концентрации веществ составляют [CO2]p = 0, 3; [CO] p = 0, 2; [COCl2]p = 1, 2 моль/л. Вычислить константу равновесия системы и исходные концентрации CO и Cl2.
Решение. Найдем константу равновесия, подставив числовые значения равновесных концентраций в выражение константы равновесия:
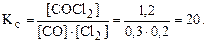
Исходная концентрация реагента равна сумме равновесной и израсходованной к моменту равновесия. Из уравнения реакции видно, что для образования 1 моль COCl2 расходуется по 1 моль СО и Cl2. Следовательно,
[CO]исх = [CO]p + [CO]изр = 0, 2 + 1, 2 = 1, 4 моль/л.
[Cl2]исх = [Cl2]p + [Cl2]изр = 0, 3 + 1, 2 = 1, 5 моль/л.
Пример 2. Равновесие реакции N2(г) + 3H2(г) ⇆ 2NH3(г) установилось при следующих концентрациях веществ: [N2] = 2, 5; [Н2] = 1, 8; [NH3] = 3, 6 моль/л. Вычислите константу равновесия реакции и исходные концентрации азота и водорода.
Решеие. Согласно выражению 5.1: 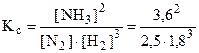 = 0, 89.
= 0, 89.
Для нахождения исходных концентраций азота и водорода учтем, что согласно уравнению реакции, из 1 моль азота получилось 2 моль NH3. Расход азота составляет половину от полученного количества аммиака, т.е. 1, 8 моль/л. Расход водорода в 3 раза больше, чем расход азота, т.е. составляет 1, 8·3 = 5, 4 моль/л. Таким образом:
[N2]исх = [N2]p + [N2]изр = 2, 5 + 1, 8 = 4, 3 моль/л.
[H2]исх = [H2]p + [H2]изр = 1, 8 + 5, 4 = 7, 2 моль/л.
Пример 3. Константа равновесия системы H2 + I2 ⇆ 2HI при некоторой температуре равна 40. Определить, какая часть водорода и иода (%) перейдет в HI, если исходные концентрации этих веществ одинаковы и составляют 0, 01 моль/л, а [HI]исх. = 0.
Решение. При решении подобных задач используется стехиометрическое уравнение реакции. Обозначим через x расход водорода к моменту наступления равновесия. Следовательно, равновесная концентрация Н2 составит [H2]p = (0, 01 - x). Так как I2 расходуется столько же, сколько и H2 (по уравнению на 1 моль H2 расходуется 1 моль I2), то
[I2]p = (0, 01 - x). Из уравнения видно, что к моменту равновесия HI получается в 2 раза больше, чем расходуется H2 , следовательно, [HI]p = 2x. Запишем выражение для константы равновесия и подставим числовые значения равновесных концентраций:
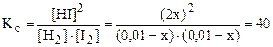 .
.
Уравнение имеет два корня: х1 = 0, 0146, х2 = 0, 0076. Из двух значений х следует выбрать то, которое отвечает условию задачи. Исходные концентрации Н2 и I2 равны
0, 01 моль/л. Таким образом, х не может иметь значение больше 0, 01 и решение имеет одно значение 0, 0076 моль/л. Таким образом, из 0, 01 моль Н2 и I2 прореагировало 0, 0076 моль, что составляет
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
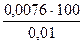 = 76%
= 76%
|
|
