
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Раздел термодинамики, изучающий тепловые эффекты химических реакций, зависимость их от состава и строения реагентов и от условий проведения реакций, называется термохимией.
|
|
В термодинамике для изучения выделяют термодинамическую с истему - совокупность тел, выделенную из окружающего пространства и являющуюся объектом исследования.
Чаще всего имеют дело с закрытыми системами, которые не обмениваются с внешней средой веществом, но обмениваются энергией. Если же нет обмена и энергией, то это - изолированная система.
Системы могут отличаться количеством фаз.
В гомогенной системе все вещества находятся в одном агрегатном состоянии, в одной фазе.
В гетерогенной системе вещества находятся в различных агрегатных состояниях, нескольких фазах.
Фаза – это часть системы, однородная во всех ее точках по химическому составу и свойствам и отделенная от других фаз системы поверхностью раздела.
Одна и та же система может находиться в различных состояниях. Для характеристики состояния системы используются такие измеримые свойства, как масса (m), температура (Т), объем (V), давление (P), концентрация (С) и др. - термодинамические параметры.
На основании этих простых параметров можно определить другие, более сложные, переменные величины, которые также используются для характеристики состояния системы и тех изменений, которые в ней происходят - термодинамические функции. Часть таких функций являются функциями состояния. Это такие функции, которые зависят от начальных и конечных параметров и не зависят от пути процессов. Таковыми являются внутренняя энергия и некоторые другие функции.
Другие термодинамические функции, например, тепловые эффекты (Q) и работа, совершаемая системой (А), не являются функциями состояния.
Внутренняя энергия (U) – это функция состояния, которая характеризует полный запас энергии системы. Ее абсолютную величину нельзя определить, однако на практике достаточно знать изменение энергии при переходе системы из одного состояния в другое.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Изменение состояния системы, сопровождающееся изменением хотя бы одного из параметров системы во времени, называется термодинамическим процессом.
Процессы при постоянной температуре называют изотермическими, при постоянном объеме - изохорными, при постоянном давлении - изобарными.
Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает первый закон термодинамики:
 . (4.1)
. (4.1)
Первый закон термодинамики является формой выражения закона сохранения энергии. Согласно этому закону, энергия не исчезает и не возникает, она переходит из одной формы в другую в строго определенных, всегда эквивалентных количествах. В данном случае тепловая энергия расходуется на изменение внутренней энергии и на работу системы против внешних сил или на работу внешних сил над системой.
Для изохорного процесса уравнение (4.1) запишется в виде 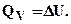
Для изобарного процесса:
Qp = DU + РDV = U2 - U1 + pV2 - pV1 = (U2 + pV2) - (U1 + pV1).
Обозначая (U + pV) º Н, получим функцию H, которая носит название энтальпия процесса. Тогда
Qp = H2 - H1 = DH = DU + pDV. (4.2)
Изменение энтальпии (DН) - тепловой эффект изобарно-изотермического процесса.
Поскольку значение DН определяется разностью Н2 и Н1 и не зависит от пути и способа проведения процесса, энтальпия является функцией состояния системы (так же как и U).
|
|
