
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Закон Гесса и его следствия
|
|
В основе термохимических расчетов лежит закон открытый российским ученым Гессом Г. И. (1841 г.). Суть его в следующем: тепловой эффект химической реакции зависит только от начального и конечного состояния системы, но не зависит от пути процесса, то есть от числа и характера промежуточных стадий. Это, в частности, значит, что термохимические реакции можно складывать вместе с их тепловыми эффектами.
Например, образование CO2 из углерода и кислорода можно представить следующей схемой:
С+О2 DН1 СО2 1. C(граф.) +O2 (г) = CO2 (г), DН01 = -396 кДж.
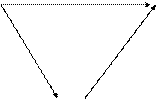 |
2. C(граф.) + 1/2O2 (г) = CO (г) , DН02 = Х кДж.
DН2 DН3
3. CO (г) + 1/2O2 (г) = CO2 (г), DН03 = -285, 5кДж. 
СО + ½ О2 Из закона Гесса следует, что DHо1 = DHо2 + DHо3.
Следовательно:
DHо2 = DHо1 - DHо3 = -396 - (-285, 5) = -110, 5 (кДж).
Очевидно, пользуясь законом Гесса, можно находить теплоту реакций, которые невозможно определить экспериментально.
Согласно следствию из закона Гесса, тепловой эффект реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (реагентов).
DН0х.р. = å nпрод·DHоƒ прод - å nисх·DНоƒ реагентов , (4.3)
где n - количество вещества; DНоƒ - стандартная энтальпия (теплота) образования вещества.
Тепловой эффект реакции образования 1 моль сложного вещества из простых веществ, определенный при стандартных условиях, называется стандартной энтальпией образования этого вещества (DНообраз или DНоƒ кДж/моль).
Стандартные энтальпии образования простых веществ в их наиболее устойчивых формах принимаются равными нулю.
Например: DНоƒ (О2) = 0, но DНоƒ (О3) = 142, 3 кДж/моль. Стандартные энтальпии образования определены для многих веществ и проведены в справочниках (табл. 4.1).
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Согласно выражению (4.3) для реакции аА+ вВ = сС + dD
тепловой эффект определяется:
DHо298 х.р.= (cDНоƒ, C + dDНоƒ , Е) - (аDHоƒ , A + вDHoƒ , B).
Второе следствие закона Гесса относится к органическим веществам. Тепловой эффект реакции с участием органических веществ равен сумме теплот сгорания реагентов за вычетом теплот сгорания продуктов.
При этом теплота сгорания определяется в предположении полного сгорания: углерод окисляется до CO2, водород - до H2O, азот - до N2.
Тепловой эффект реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов называется теплотой сгорания этого вещества (DНосг.). При этом очевидно, что теплоты сгорания O2, CO2, H2O, N2 принимаются равными нулю.
Например, теплоту сгорания этанола по реакции
C2H5OH(ж) + 3O2 = 2CO2 + 3H2O(г)
можно рассчитать по уравнению (4.3):
DHох.р. = DНосг(C2H5OH) = 2DНоƒ, (CO2) +3DНоƒ, (H2O) - DНоƒ, (C2H5OH).
Подставляя данные из таблицы 4.1, получаем стандартную теплоту сгорания этанола:
DНосг (C2H5OH) = 2(-393, 5) + 3(241, 8) – (-277, 7) = -1234, 7 кДж/моль.
Значения теплот сгорания приведены в справочниках.
Таблица 4.1
Термодинамические константы некоторых веществ
| Вещество | DН0f, 298, кДж/ моль | S0298, Дж/ моль× K | DG0f, 298, кДж/ моль | Вещество | DН0f, 298, кДж/ моль | S0298, Дж/ моль× K | DG0f, 298, кДж/моль |
| Al2O3(кр) | -1676, 0 | 50, 9 | -1582, 0 | Cr2O3(кр) | -1140, 6 | 281, 0 | -1059, 0 |
| BaO(кр) | -558, 1 | 70, 3 | -528, 4 | CuO(кр) | -162, 0 | 42, 6 | -129, 4 |
| ВеО(кр) | -598, 0 | 14, 1 | -581, 6 | CuCl2(ж) | -227, 6 | 210, 9 | -244, 6 |
| BeCO3(кр) | -982, 0 | 67, 3 | -944, 8 | H2O(ж) | -285, 8 | 70, 08 | -237, 3 |
| С(графит) | 5, 7 | H2O(г) | -241, 8 | 188, 7 | -228, 6 | ||
| Cl2(г) | 222, 9 | H2SO4(ж) | -814, 2 | 156, 9 | -690, 3 | ||
| CaO(кр) | -635, 5 | 39, 7 | -604, 2 | HCl(ж) | -166, 9 | 56, 5 | -131, 2 |
| CaH2(кр) | -188, 7 | 42, 0 | -149, 8 | HCl(г) | -91, 8 | 186, 7 | -94, 8 |
| CaCO3(кр) | -1206, 9 | 92, 9 | -1128, 8 | H2S(г) | -21, 0 | 205, 6 | -33, 8 |
| O2(г) | 205, 0 | H2 | 130, 5 | ||||
| Ca(OH)2 | -986, 6 | 76, 1 | -896, 8 | NH3(г) | -46, 2 | 192, 5 | -16, 7 |
| CH4 | -74, 9 | 186, 2 | -50, 8 | NO | 90, 3 | 210, 6 | 86, 6 |
| C2H4 | 52, 3 | 219, 4 | 68, 1 | NO2 | 33, 0 | 240, 5 | 51, 5 |
| C2H6 | -89, 7 | 229, 5 | -32, 9 | NH4Clкр | -314, 2 | 94, 5 | -203, 2 |
| C6H6(ж) | 82, 9 | 269, 2 | 129, 7 | P2O5(кр) | -1492 | 114, 5 | -1348, 8 |
| C2H2 | 226, 8 | 200, 8 | 209, 2 | SO3(ж) | -439, 0 | 122, 1 | -368, 1 |
| C3H8(г) | -103, 85 | 269, 9 | - | Fe | 27, 2 | ||
| CH3OH(ж) | - | 126, 8 | - | FeO(кр) | -264, 8 | 60, 7 | -244, 3 |
| C2H5OH(г) | -235, 3 | - | - | Fe3O4(кр) | -1117, 1 | 146, 2 | -1014, 2 |
| CO | -110, 5 | 197, 5 | -137, 1 | Fe2O3(кр) | -822, 2 | 89, 9 | -740, 3 |
| CO2 | -393, 5 | 213, 6 | -394, 3 | Ti(кр) | 30, 6 | ||
| CS2(г) | 115, 3 | - | - | TiO2(кр) | -943, 9 | 50, 3 | -888, 6 |
Пример 1. Определить тепловой эффект реакции дегидратации этанола, если
DHосг (C2H4) = -1422, 8; DHосг (H2О) = 0; DНосг (C2H5OH) = - 1234, 7 (кДж/моль).
Решение. Запишем реакцию: C2H5OH(ж) = C2H4 + H2O.
Согласно второму следствию определяем тепловой эффект реакции по теплотам сгорания, которые приведены в справочнике:
DHо298 х.р = DHосг(C2H5OH) - DHосг(C2H4) - DHосг(H2O) =
-1234, 7 + 1422, 8 = 188, 1 кДж/моль.
В технике для характеристики тепловых качеств отдельных видов топлива обычно используют их теплотворную способность.
Теплотворной способностью топлива называется тепловой эффект, который соответствует сгоранию единицы массы (1кг) для твердых и жидких видов топлива или единицы объема (1м3) для газообразного топлива.
С помощью закона Гесса и его следствий можно определять многие величины, в том числе не определяемые экспериментально, если соответствующую неизвестной величине реакцию можно получить, складывая другие реакции с известными характеристиками.
Пример 2. Исходя из теплового эффекта реакции
3СаО(т) + Р2О5 (т) = Са3(РО4)2 (т), DНо298 = -739 кДж,
определить энтальпию образования ортофосфата кальция.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Решение. По следствию из закона Гесса:
DHо298 х.р = DНоƒ, Са3(PO4)2 - (3DНоƒ, СаО + DНоƒ, P2O5).
Из табл. 4.1: DНоƒ, (СаО) = -635, 5; DНоƒ, (P2O5)= -1492 (кДж/моль).
DНоƒ, Са3(PO4)2 = -739 + 3·(-635, 5) - 1492 = -4137, 5 кДж/моль.
Пример 3. Написать термохимическое уравнение реакции сгорания твердой серы в N2O, если известно, что при сгорании 16 г серы выделяется 66, 9 кДж тепла
Решение. Чтобы записать термохимическое уравнение, надо рассчитать тепловой эффект реакции:
S(т) + 2N2O(г) = SO2 (г) + 2N2 (г); DHо298 х.р = Х кДж.
По условию задачи известно, что при сгорании 16 г серы выделяется 66, 9 кДж, а в реакции участвует 32 г серы. Составляем пропорцию:
16г - 66, 9 кДж
32г - X кДж X = 133, 8 к Дж.
Таким образом, термохимическое уравнение записывается так:
S(т) + 2N2O(г) = SO2 (г) + 2N2 (г), DНо х..р.= -133, 8 кДж.
(Так как тепло выделяется, реакция экзотермическая, DН0< 0).
Пример 4. Какое количество теплоты выделится при соединении 5, 6 л водорода с хлором (н. у.), если энтальпия образования хлористого водорода равна -91, 8 кДж/моль (температура продуктов и реагентов равна 250 С).
Решение. DНоƒ, (HCl) = -91, 8 кДж/моль, это значит, что при образовании одного моля HCl из простых веществ выделяется 91, 8 кДж тепла, что соответствует термохимическому уравнению:
½ Cl2 + ½ H2 = HCl, DHоƒ = -91, 8 кДж.
Из уравнения видно, что для получения 1 моль HCl расходуется 0, 5 моль Н2, т. е. 0, 5·22, 4 л = 11, 2 л. Составляем пропорцию:
11, 2 л - 91, 8 кДж
5, 6 л - X X = 45, 2 кДж.
Ответ: выделится 45, 19 кДж тепла.
Пример 5. Определить энтальпию образования оксида железа (III), исходя из трех термохимических уравнений (справочником не пользоваться):
1) Fe2O3 + 3CO = 2Fe + 3CO2 , DН01 = -26, 5 кДж;
2) С(графит) + ½ O2 = CO, DН02 = -110, 4 кДж;
3) СO2 = C(графит) + O2 , DН03 = + 393, 3 кДж.
Решение: Запишем уравнение, тепловой эффект которого нужно определить:
4Fe + 3O2 = 2Fe2O3; DН04 = 2Х кДж.
Чтобы из первых трех уравнений получить четвертое, надо уравнение 1) умножить на (-2), а уравнения 2) и 3) – на (-6) и сложить:
1) 4Fe + 6CO2 = 2Fe2O3 + 6CO, DН01 = 2·(+26, 5) кДж;
2) 6CO = 6С(графит) + 3O2, DН02 = 6·(+110, 4) кДж;
3) 6C(графит) + 6O2 = 6СO2 , DН03 = 6·(-393, 3) кДж;
DН04 = 2DН01 + 6DН02 + 6DН03 = +53 + 662, 4 - 2359, 8 = -1644, 4 кДж.
Отсюда DН0ƒ (Fe2O3) = - 822, 2 кДж/моль.
|
|
